|
ARACNET 10 - Bol. S.E.A., nº 31 (2002) : 205–216
TÉCNICAS:
Técnicas de preparación microscópica, tinción e inclusión para dermatopsias en los lepidópteros (Insecta: Lepidoptera)
Rafael Magro
C/Argales nº 11, 1º C, 47013.Valladolid. rmagro@teleline.es.
Resumen: En este trabajo se analizan diferentes técnicas para la preparación, fijación, tinción e inclusión microscópica de dermatopsias en los lepidópteros, con especial atención al exoesqueleto larval, las cápsulas cefálicas y escleritos abdominales de adultos.
Palabras clave: Dermatopsia, quetotaxia, tinción, inclusión, Lepidoptera.
Techniques for preparing, staining and mounting lepidopteran microscope dermatopsies (Insecta: Lepidoptera)
Abstract:
Techniques for preparing, fixing, staining and mounting microscope dermatopsies in lepidopterans are analysed, with special attention paid to the larval exoskeleton, cephalic capsules and the adults’ abdominal sclerites.Key words: Dermatopsy, chetotaxy, staining, mounting, Lepidoptera.
Indice:
Introducción
Material y métodos
I. Preparación de la piel del cuerpo larval
Disección y maceración. Técnicas de fijación. Técnicas de Tinción. Medios y métodos de inclusión.
II. Preparación de cápsulas cefálicas larvales
Disección y maceración. Fijación. Tinción.
III. Preparación de escleritos abdominales de adultos
Disección y maceración. Fijación. Tinción. Medios y métodos de inclusión.
IV. Otras preparaciones
V. Decoloración de estructuras
VI. Comentarios sobre los medios y métodos de inclusión, deshidratación y tinción
Retoques y tinción puntual
Conclusiones
Bibliografía
ANEXOS
Introducción
Es muy común encontrar en la bibliografía el uso, que creemos ambiguo, del término quetotaxia para referirse a las preparaciones de piel. Siendo estrictos, la etimología de la palabra indica ‘disposición del pelo’. Es decir, el estudio de la ubicación de las cerdas que hay en el exoesqueleto. Es frecuente leer frases como ‘quetotaxia de la pata’ para referirse al estudio completo de la pata, ‘quetotaxia de la cabeza’, para el examen de las cápsulas cefálicas, ‘quetotaxia del tórax’, etc. Proponemos el término genérico dermatopsia, es decir, ‘visión de la piel’, para estudios completos de la piel. El término quetotaxia debería utilizarse, exclusivamente, cuando el análisis se refiera únicamente a la disposición de los pelos.
En el presente artículo se presentan y analizan diferentes técnicas para la preparación, fijación, tinción e inclusión microscópica de dermatopsias en los lepidópteros, con especial atención al exoesqueleto larval, las cápsulas cefálicas y escleritos abdominales de adultos.
Con respecto a los antecedentes bibliográficos pueden consultarse Beck, 1960 y 1989; Hinton, 1946. Para técnicas microscópicas en general pueden consultarse Fernández-Rubio, 1982; Martínez, 2002; Gabe, 1968; Martoja & Martoja, 1967, Pearse, 1968; Vives-Moreno, 1988; Bernis-Mateu, 1973. Las conclusiones que se han obtenido en este trabajo se basan en la realización de 1282 preparaciones.
Material y métodos
Aquellos lectores que no estén familiarizados con los tratamientos más usuales en la preparación de genitalias y en los de estructuras microscópicas de lepidópteros en general, han de saber que las cantidades de líquidos con que se hacen los tratamientos, mientras no se indique lo contrario, deberán acomodarse a los tamaños de los cuerpos que se van a tratar. Como norma general, los líquidos usados deberán cubrir ampliamente las estructuras. Igualmente, si no se dan indicaciones concretas, es preciso decir que la temperatura que se toma como referencia para los diferentes procesos es de 18ºC. Con respecto al tiempo, si no se indica explícitamente, sucede lo mismo que con las cantidades. Como es obvio, no es igual tratar las partes de un macroheterócero que las de un microlepidóptero. Debido a las grandes diferencias, en lo que respecta a las medidas de las estructuras entre las distintas especies, resulta imposible indicar específicamente estas cantidades y se ha de confiar para ello en la experiencia de cada operador.
No detallaremos aquí nada más que los utensilios más específicos y/o poco usuales, entendiendo que son necesarios los más comunes, como por ejemplo: tubos de Pyrex, gradilla, cristalizador, agujas enmangadas, asa de platino, sondas, jeringuillas, baño María con termostato, termómetro, pinzas, pocillos de cerámica, bisturíes, microtijeras, frasco lavador, probetas, balanza, microscopio estereoscópico, etc.
I. Preparación de la piel del cuerpo larval
Disección y maceración:
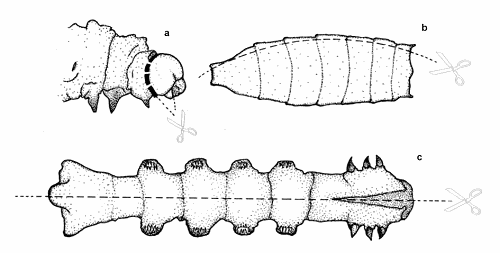
Antes de comenzar la preparación del exoesqueleto larval es recomendable dejar a las orugas en ayuno durante al menos dos o tres días. De esta manera, se evita que el contenido intestinal tiña o manche la piel de las orugas. La muerte se provoca con cualquier método conocido (véase Schauff, 1986: 24-26), con vapores tóxicos, por inmersión en agua a 1º C, o por calentamiento a 80º C. Hay que tener en cuenta que el acetato de etilo y el cianuro, pueden alterar su coloración. Si la larva no es muy grande también se puede utilizar 1,1,2,2- tetracloroetano (léase Fernández-Rubio, 1985: 102). Posteriormente, si la oruga es grande, se realiza la ablación de la cabeza con unas microtijeras y se da un corte longitudinal en la zona ventral, desde la cabeza hasta el anus (para anatomía larval véase Eaton, 1987: 193-197, Snodgrass, 1997: fig.196, hasenfuss, 1963, Hinton, 1946 y Steinmann & Zombori, 1984). Hay que procurar no cortar el recto y el saco rectal, que luego resultará muy útil para posteriores manipulaciones (lám 1, fig. 13). Esta incisión debe ser realizada perfectamente centrada, entre las patas torácicas y las abdominales (fig.1 c). Los siguientes pasos son: maceración, limpieza, fijación, tinción, aclarado, deshidratación y montaje (fig.2). Para la maceración introducir la cabeza y el cuerpo abierto en un tubo que contenga una solución de hidróxido potásico al 15%, si la oruga es grande. Cuanto menor sea su tamaño y más fina la piel, menor debe ser la concentración de hidróxido potásico, pudiéndose llegar a utilizar concentraciones del 5%. Calentar al baño María, como máximo 5 minutos, a 80º C. Finalizado el tiempo hay que proceder a una variante de la técnica de agitación descrita por Magro & De La Torre (2002: 184). Se trata de agitar el tubo enérgicamente unas 20 veces y quitar la espuma que se forme con unas gotas de alcohol isopropílico. Una vez concluido este proceso, se introduce la larva en agua desionizada, agitando nuevamente unas 10 veces y se repite la operación como se ha descrito, finalmente se agita 5 veces más (véase fig. 4). Para terminar, aclarar con abundante agua. Después de estas operaciones el exoesqueleto y su cápsula cefálica deberían estar perfectamente limpias, si no fuese así habría que realizar una última limpieza manual con la siguiente solución de limpieza:
Solución de limpieza A
Agua desionizada 65 ml
Ácido acético 35 ml
Una vez concluida la limpieza manual aclarar concienzudamente con agua, si no se realiza de esta manera, es posible que las soluciones que empleemos para teñir no se fijen adecuadamente. Si las preparaciones que se desean realizar son de partes con piel fuertemente quitinizada y pigmentada pueden macerarse en la siguiente solución oxidante:
Solución de maceración A
Agua desionizada 80 ml
Permanganato potásico 10 gr
Alumbre de roca...........................10 gr
El permanganato teñirá los tejidos de un fuerte color morado que cambiará de tonalidad al marrón oscuro en contacto con el aire, estabilizándose a los pocos días. Esta tonalidad aclara con el tiempo y ha de lavarse concienzudamente con esta fórmula:
Solución decolorante A
Agua desionizada 100 ml
Ácido oxálico 10 gr
Se decolora mejor con el ácido oxálico pero es muy tóxico y se puede sustituir por sulfito sódico o bisulfito sódico al 10% en agua. Aclarar abundantemente. Después se bañan a 80ºC durante el tiempo necesario, en la siguiente solución:
Solución de maceración B
Agua desionizada 100 ml
Hidróxido potásico 30 gr
Una vez que se considere que las partes están suficientemente claras se lavan bien con agua o con ácido cítrico al 30% en agua, finalizando el proceso con un nuevo aclarado. Si las orugas son muy pequeñas (inferiores a unos 3 mm), es muy difícil hacer el corte longitudinal y la ablación de la cabeza, por lo que se montarán enteras. Se calentarán en hidróxido potásico al 5% a 80 ºC durante 2 minutos, o bien durante una hora o más en frío. Después se presionará con un pincel, por debajo de la cabeza, con cuidado de no deteriorar la cápsula cefálica, hasta que el contenido corporal salga por el anus. Se volverán a introducir en hidróxido potásico, se agitarán de manera no muy agresiva y se aclararán con agua.
|
Fig. 1. Línea de corte de la cabeza (arriba, izda.), escleritos (arriba, dcha.) y cuerpo larval (abajo). |
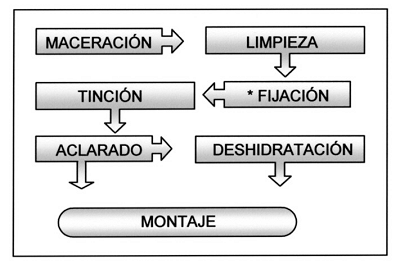
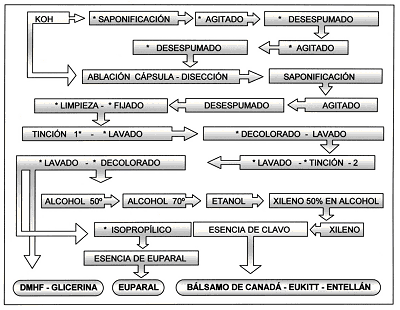
Fig 2. Diagrama de procesos (*: pasos opcionales). |
Técnicas de fijación:
Se puede entender por técnicas de fijación dos conceptos: 1º la conservación de los tejidos, células y estructuras en el estado más aproximado posible a la materia viva; 2º la fijación de los colorantes con otras sustancias, para que sean estables, longevos, que penetren y tengan un poder cromógeno adecuado para el uso que se persigue. Al empleo de estas sustancias se le llama comúnmente, utilización de mordiente, aunque la palabra ‘mordiente’ tiene otra acepción radicalmente distinta, generando cierta confusión. Mordiente, también es el punto en que algunas sustancias, muy cercanas al secado, están ligeramente pringosas al tacto, pero no manchan, por ejemplo en la técnica del Mixtión. Algunos autores para evitar la ambivalencia del término emplean la palabra curtiente, que es la que nosotros usaremos. Las larvas muy pequeñas deben de fijarse con solución Ringer (Langeron, 1969) y/o AFATD (Martínez, 2002:187). La fijación de los colores puede realizarse preparando previamente las partes a teñir, para que el reactivo penetre profundamente, o bien después de la tinción para consolidar los colores. Esto depende de que proceso de tinción se trate, aunque en la mayoría de los casos no es necesario. Para la fijación de los colores, en general, empleamos la siguiente fórmula curtiente:
Solución curtiente A
Agua desionizada 100 ml
Alumbre de roca 10 gr
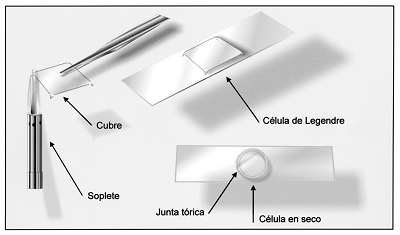
Fig. 3. Fabricación de la célula de Legendre y célula para preparaciones en seco. |
|
Fig. 4. Diagrama de procesos (*: pasos opcionales). |
Técnicas de Tinción:
Los colorantes que se han de utilizar dependen del grado de pigmentación y de pilosidad del exoesqueleto larval, del grado de contraste que se necesite y del medio de montaje que se vaya a usar. Para larvas con exoesqueleto poco quitinizado se puede utilizar la siguiente técnica de doble tinción. Se introduce la piel durante 4 minutos en la siguiente solución colorante:
Solución colorante A
Etanol 100 ml
Fuscina básica 5 gr
En vez fucsina se puede emplear picrocarmín (Bernis-Mateu, 1973:52) o hematoxilina de Heidenhaim (léase Martínez, 2002:191). Seguidamente durante 6 minutos en la solución:
Solución colorante B
Agua desionizada 100 ml
Azul de metileno 5 gr
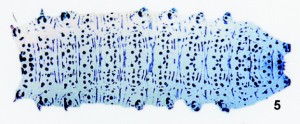
Se puede sustituir el azul de metileno por azul de toluidina. Aclarar con agua (lám. 1, fig. 5) También da muy buenos resultados introducir los tejidos durante 5 minutos a 80ºC en la siguiente solución:
Solución colorante C
Agua desionizada 80 ml
Índigo 10 ml
Bisulfito de sosa 5 gr
Ésta se realizará de la siguiente manera: mezclar el índigo con unas gotas de etanol en un almirez y con la mano de cerámica, hacer una pasta. Luego añadir el agua con el bisulfito de sosa y calentarlo a un máximo de 80 ºC con los exoesqueletos dentro, en un frasco tapado. Este tinte actúa por reducción-oxidación, las preparaciones salen color azul muy tenue y en contacto con el oxígeno del aire van oscureciendo en breves segundos. Se puede repetir la operación tantas veces como se crea necesario, pero hay que mantener el líquido en el recipiente, convenientemente cerrado, destapar para meter las preparaciones y tapar lo más rápidamente que sea posible. Fijar con la solución curtiente A y lavar con agua. El sistema es lento, pero se pueden controlar las tonalidades de manera muy precisa. La solución no se conserva. Si se ha producido una severa sobrecoloración (tanto en la primera técnica, como con el índigo) se puede usar la solución propuesta por Vives-Moreno, (1988:43), que es la siguiente:
Solución decolorante B
Agua desionizada 50 ml
Etanol 25 ml
Ácido acético 25 ml
Si es una sobrecoloración no muy severa basta rebajar la solución en agua, no obstante la preparación debería de tener unas tonalidades bastante fuertes dado que en la posterior deshidratación perderá un poco de brillo, contraste y tonalidad. Seguidamente aclarar con abundante agua. Si la preparación no está lo suficientemente limpia se puede utilizar el mismo líquido para finalizar. Con
esta técnica se conseguirá que las partes más quitinosas se tiñan de tonalidades cercanas al añil y el resto del tejido con tonos magenta. Para tejidos larvales muy quitinizados proponemos la siguiente técnica de doble tinción. Se introduce la piel durante 4 minutos en la siguiente solución colorante:
Solución colorante D
Agua desionizada 100 ml
Verde HE 10 gr
Azul de metileno 10 gr
Fenol 2 gr
El verde y el azul se pueden reemplazar con verde luz y azul de toluidina, empleando la mitad de la proporción, es decir, 5 gr. Seguidamente se pasa, agitando lentamente, durante 1 minuto, a una solución de mercuresceína sódica, proporción 1:1000. Este reactivo se puede sustituir por mercromina comercial, pero ésta da una coloración más clara y con una fluorescencia amarillo-verdosa mucho más acentuada que, en algunos casos, pudiera resultar molesta. La mercromina comercial, dependiendo de las marcas, puede tener diferentes concentraciones. Los aditivos y excipientes pueden ser variados y la combinación con éstos pueden provocar que las preparaciones se oscurezcan con el tiempo. Se aclara con agua desionizada. La coloración debe ser bastante acentuada dado que en los pasos de deshidratación, como ya se comentó anteriormente, la preparación perderá parte de su tonalidad aclarándose. No obstante si se ha producido una sobrecoloración se puede rebajar con la siguiente solución decolorante:
Solución decolorante C
Agua desionizada 20 ml
Etanol 78 ml
Ácido acético 2 ml
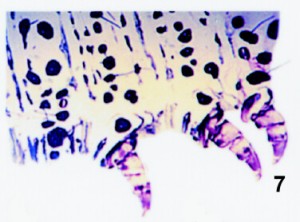
Seguidamente aclarar con abundante agua. Si la preparación no está lo suficientemente limpia se puede utilizar el mismo líquido para terminar. Con esta técnica se conseguirá que las partes más quitinosas se tiñan de color verde azulado y el resto del tejido con una variable gama de magentas (lám. 1, fig. 6). Es necesario resaltar, que estos métodos de tinción sólo se pueden aplicar si el medio de montaje que se va ha utilizar requiere la deshidratación previa de los tejidos. Si las estructuras se incluyen en otros medios, como por ejemplo, aquellos en que las preparaciones se pueden montar directamente con alcohol, los hidrosolubles o los que poseen en su fórmula hidrato de cloral, las preparaciones se pueden desteñir (véase el apartado medios de inclusión). Para montar los exoesqueletos, por ejemplo, en Euparal, (que se diluye en alcohol), se introducen los tegumentos durante 2 minutos en orceína acética B. Al término se aclaran con agua y se bañan las partes con la solución colorante B durante 4 minutos. Aclarar con agua y meter en la solución de orceína. Fijar con alcohol isopropílico. Para decolorar se puede usar la solución decolorante A (lám. 1, fig. 7). Si el medio de inclusión es hidrosoluble, por ejemplo, DMHF o se desean almacenar las preparaciones en frascos con glicerina o soluciones de la misma, se usará el siguiente líquido durante 1 minuto:
Solución colorante E
Agua desionizada 100 ml
Negro de clorazol 0,1 gr
Se aclaran y se limpian los tejidos de los residuos del negro (consúltese Carayon, 1969) y se vuelven a teñir durante 2 minutos con la solución colorante A. Se lavan con abundante agua y se vuelven a introducir 30 segundos, si es necesario, en la solución colorante E. El negro de clorazol es difícil de decolorar. Si las preparaciones se sobrecoloran, se puede utilizar la solución de limpieza A. Si no se consigue la tonalidad deseada se puede utilizar la siguiente solución durante más de 24 horas:
Solución decolorante D
Agua desionizada 100 ml
Hidrato de cloral 10gr
Se efectúa un profundo lavado y se dejan secar las preparaciones completamente, a temperatura ambiente. Para montarlas hay que volver a hidratarlas. De esta manera las preparaciones no se destiñen en el DMHF ni en la glicerina. Las partes quitinosas adquieren una tonalidad gris oscura y el resto del tejido rosas y azules grisáceos (véase lámina 1, figs. 8 y 10).
|
Fig. 5. Preparación de piel larval número 335-409 de Cucullia verbasci (Linnaeus, 1758), (det. 9-VII-1993). Se empleó para teñir azul de metileno + verde He (solución D). |
Fig. 6. Preparación de piel larval número 334-407 de Cucullia verbasci (L.), (det. 9-VII-1993). Se empleó para teñir azul de metileno + verde He è mercuresceína (solución D è mercuresceína). |
|
Fig. 7. Preparación de piel larval número 548-873 de Cucullia thapsiphaga Treitschke, 1826, (det. 4-V-1996). Fragmento de los cuatro primeros segmentos. Se empleó para teñir orceína acética è azul de metileno (B) è orceína acética. |
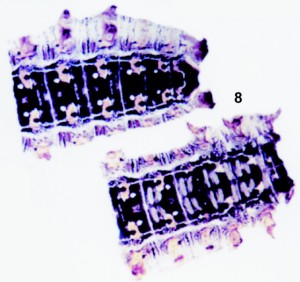
Fig. 8. Preparación de piel larval número 533-843 de Cucullia lychnitis Rambur, 1833, (det. 4-IV-1996). Larva en último estadio que por su gran tamaño, se montó en dos partes. Se empleó para teñir negro de clorazol è fucsina básica è negro de clorazol (solución E è A è E). Este ejemplar presentaba una grave enfermedad con extrema pérdida de pigmentación, las amplias zonas marrones se pusieron de relieve tras la tinción (nótese que los puntos y las rayas dorsales blancos, en realidad deberían ser negros, y las zonas marrones transparentes, como corresponde a la especie a la que pertenece). |
|
Fig. 9. Preparación de piel larval número 656-1086 de Cucullia thapsiphaga Tr. (det. 15-VII-2002). Fragmento de los tres primeros segmentos. Se empleó para teñir azul de metileno è mercuresceína (solución B è mercuresceína). |
Fig. 10. Preparación de piel larval número 657-1088 de Cucullia thapsiphaga Tr. (det. 15-VII-2002). Fragmento de los primeros segmentos. Se empleó para teñir negro de Clorazol è fucsina básica è negro de clorazol (solución E è A è E). |
|
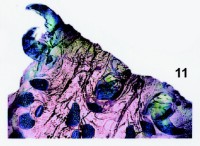
Fig. 11. Preparación de piel larval número 660- 1094 de Cucullia lychnitis Rbr. (det. 15-VII-2002). Fragmento de los primeros segmentos. Se empleó para teñir azul de metileno + verde HE è fucsina básica (solución D è A). |
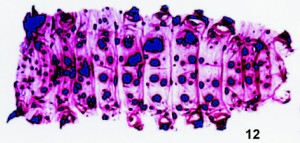
Fig. 12. Preparación de piel larval número 661-1096 de Cucullia thapsiphaga Tr. (det. 15-VII-2002). Se empleó para teñir azul de metileno è fucsina básica (solución B è A). Ejemplar con grave enfermedad, los puntos azules, corresponden con la facies de la misma, que se pusieron de relieve tras la tinción y no con los puntos larvales relativos a la especie. |
|
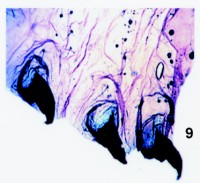
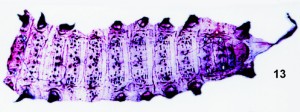
Fig. 13. Preparación de piel larval número 663-1100 de Cucullia thapsiphaga Tr. (det. 20-VII-2002). Se empleó para teñir Vigencial è mercuresceína (solución F1 è mercuresceína sódica). Nótese la conservación del tubo anal, muy útil para usarlo a modo de asidero y manipular con comodidad la piel. |
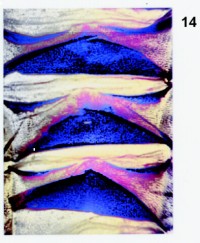
Fig. 14. Preparación número 269-314 de escleritos abdominales de un adulto hembra de Agrotis (Crassagrotis) obesa [Boisduval, [1828]), (det. 2-IV-1993). Fragmento, 3º, 4º y 5º esternito en norma ventral. Se empleó para teñir orceína acética è azul de metileno (B) è orceína acética. |
|
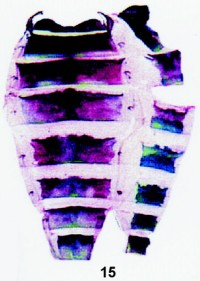
Fig. 15. Preparación número 277-324 de escleritos abdominales de un adulto macho de Eurranthis plummistaria (Villers, 1789), (det. 4-IV-1993). Se empleó para teñir azul de metileno + verde He è Fucsina básica (solución D è A). |
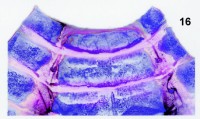
Fig. 16. Preparación número 266-310 de escleritos abdominales de un adulto macho de Zygaena (Zygaena) lavandulae barcelonica Reiss, 1936, (det. 1-IV-1993). Fragmento, 6º, 5º y 4º esternito. Se empleó para teñir negro de clorazol è fucsina básica è negro de clorazol (solución E è A è E). |
|
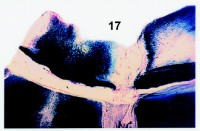
Fig. 17. Preparación número 274-319 de escleritos abdominales de un adulto macho de Cossus cossus (Linnaeus, 1758), (det. 4-IV-1993). Fragmento de los últimos uroesternitos. Se empleó para teñir azul de metileno (B) è mercuresceína. |
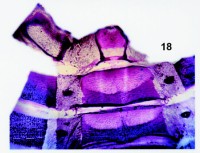
Fig. 18. Preparación número 313-370 de escleritos abdominales de un adulto macho de Euxoa (Euxoa) temera (Hübner, [1808]), (det. 6-VII-1993). Fragmento de los últimos uroesternitos. Se empleó para teñir Vigencial è fucsina básica (solución F1 è A). |
|
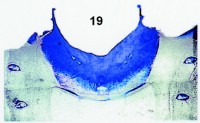
Fig. 19. Preparación número 267-312 de escleritos abdominales de un adulto hembra de Agrotis (Crassagrotis) crassa (Hübner, [1803]), (det. 2-IV-1993). Fragmento de los primeros esternitos. Se empleó para teñir azul de metileno + verde He (solución D). |
Fig. 20. Preparación número 254- 292, de escleritos abdominales de un adulto macho de Habrosyne pyritoides (Hufnagel, 1766), (det. 20-III-1993). Fragmento de los últimos esternitos. Se empleó para teñir Fucsina básica è azul de metileno (solución A è B). |
|
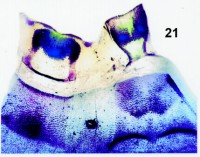
Fig. 21. Preparación número 260-301, de escleritos abdominales de un adulto macho de Agrotis (Crassagrotis) crassa (Hb.), (det. 28-III-1993). Fragmento de los últimos uroesternitos. Se empleó para teñir Azul de metileno + verde He è mercuresceína (solución D è mercuresceína). ( Todas las preparaciones y los ejemplares se encuentran depositados en la colección del autor. Rafael Magro, Det. et Leg.). |
|
Medios y métodos de inclusión:
Como ya se ha comentado hay de varias clases, unos necesitan que los exoesqueletos estén deshidratados, otros son hidrosolubles y algunos admiten tegumentos deshidratados con alcohol isopropílico. Todos tienen ventajas e inconvenientes (véase anexo comparativo VI). Para montar entre porta y cubre algunas larvas de gran tamaño, es necesario emplear cubreobjetos de gran formato, por ejemplo, de 24 x 32 mm o mayores. Si las mismas superan el largo del porta, hay portas de gran formato en el comercio, pero su uso conlleva la adquisición de cajas especiales. Una manera de montarlas es seccionar la piel de larvas transversalmente por la mitad (lám 1, fig. 8). Si los tejidos son de gran grosor el cubre debe de separarse lo suficiente del porta como para no aplastar las preparaciones, en este caso se pueden usar trocitos de cristal con el suficiente grosor como para separarlos (Yela, com. pers.). También se pueden utilizar esquineras de hilo de plata o de latón, arandelas de P.V.C., etc. El método que consideramos, con diferencia, el más adecuado es el montaje en célula de Legendre. Se trata de doblar los ángulos con un micro-soplete tipo ‘Pencil Torch’ plegando lo necesario como para conseguir el grosor deseado. Consideramos que este es el sistema más sencillo, limpio, elegante y deseable, aunque menos utilizado (fig. 3). El sistema de almacenamiento en tubos con glicerina, no es muy útil para piel de las larvas, puesto que su manipulación resulta, en muchos casos un engorro y es fácil deteriorarlas. Con respecto a las sustancias de inclusión que contienen hidrato de cloral, ácido acético o glicerina, están prácticamente en desuso, como por ej. el líquido de Hoyer, Faure, o el Berlèse, encontrándose multitud de medios más eficaces y modernos.
II. Preparación de cápsulas cefálicas larvales
Disección y maceración:
Se cortarán las cabezas, con unas pequeñas tijeras, lo más cercano al nacimiento, (fig. 1 a). Las cápsulas cefálicas larvales se maceran de la misma manera descrita para la piel del cuerpo de las larvas.
Fijación:
No se suele necesitar fijación de ningún tipo, excepto que se deseen emplear colorantes que requieran curtiente.
Tinción:
Las cápsulas cefálicas larvales se suelen almacenar en frascos de cristal en una solución a base de glicerina (véase Magro & De La Torre, 2002: 187). Por lo tanto, se deben teñir empleando la solución colorante E y la decolorante D si es necesario. Conviene teñirlas muy sutilmente puesto que su estructura es, por lo general, bastante quitinizada y posee estructuras que si se sobrecoloran no se observarían con facilidad, como por ej. la hipofaringe. Si estas cápsulas son de tamaño muy pequeño, se pueden montar entre porta y cubre. La técnica de tinción que consideramos más adecuada para medios de inclusión que requieren la deshidratación de los tegumentos, consiste en usar la solución colorante D y después mercuresceína sódica, como se describió en el anterior apartado. Aunque no hay inconveniente en aplicar cualquiera de las otras. Otro sistema es pegarlas, en seco, en etiquetas, pero las cápsulas se suelen deformar.
III. Preparación de escleritos abdominales de adultos
Disección y maceración:
Una vez separado el abdomen completo, si el ejemplar es grande y/o pertenece a un macho, se debe introducir en un tubo durante 10 minutos, que contenga una solución de hidróxido potásico al 5%, y calentar a 80º C. Si es pequeño o es hembra, en una solución al 2%. Posteriormente se procede a la ablación de la armadura genital, ya sea andropigio o ginopigio, si es posible, con todos los órganos que se puedan conservar (espermateca, tubos de Maplhigi, etc.) que seguramente serán muy útiles para posteriores estudios morfológicos. Ahora debe abrirse el abdomen, para ello realizaremos un corte longitudinal con unas microtijeras justo por encima de los espiráculos de la parte izquierda, observando la preparación en norma ventral (fig. 1 b). Se debe comenzar por el primer segmento abdominal para terminar en el último uroesternito. Seguidamente volvemos a introducir los escleritos en una nueva solución alcalina, a 80ºC, durante el tiempo que se considere necesario para que estén más o menos limpios y/o blandos. Una vez finalizada la operación, y si el abdomen es de gran tamaño, se agita tal como se describió en el apartado ‘Preparación de piel larval’, subapartado ‘Disección y maceración’. Si es pequeño o con piel muy delicada, se procederá tal como describen Magro & De La Torre, 2002: 184. Hay que comentar, que algunos abdómenes poseen coremata y/o también mechones de pelo en los uroesternitos. Estas estructuras pueden ser muy importantes para la determinación del ejemplar, en este caso, la agitación se debe hacer la mitad de las veces recomendadas y realizarlas no tan enérgicamente como se describe en el citado trabajo. Para finalizar, se aclaran los escleritos con abundante agua. De esta manera estos deberían estar completamente limpios. Si por alguna razón no es así, se hará una limpieza manual con la solución de limpieza A terminando con un nuevo aclarado. Si los abdómenes son muy pequeños (inferiores a unos 3 mm), es muy difícil hacer el corte longitudinal paralelo a los espiráculos, con lo cual se montarán enteros. Se tratarán con hidróxido potásico al 2% a 80 ºC durante 2 minutos, o bien durante una hora o más en frío, si el abdomen pertenece a un macho. Si por el contrario es una hembra la solución alcalina será al 1%. Después se presionará con un pincel, hasta que el contenido intestinal salga. Se procederá a un agitado no muy agresivo y se aclararán con agua. Si todavía han quedado algunos conductos traqueales, limpiar con el agua procedente de una jeringa, introduciendo la aguja del tamaño adecuado, hasta la mitad del hueco y luego presionar con contundencia. Esta aguja debe tener la punta roma, para lo cual ha de cortarse y pulirse de manera que desaparezcan los biseles. Puede darse el caso, de que incluso la ablación del abdomen sea difícil, o que esta operación, en ejemplares extremadamente pequeños, entrañe riesgos de deterioro de las estructuras del tórax. Para extraer el abdomen, basta golpear dorsalmente y hacia abajo, sobre el cuarto y quinto esternito, siempre y cuando el ejemplar esté seco y montado. Si el abdomen no se desprende con cierta facilidad es mejor no insistir, los ejemplares se deberán preparar enteros. Igualmente, puede suceder, que el ginopigio no se pueda separar de los uroesternitos, en cuyo caso la genitalia femenina se montará junto al abdomen o con los últimos segmentos.
Fijación:
No se suele emplear fijación de ningún tipo, a no ser que se deseen utilizar sustancias con poder cromógeno que requieran curtiente, como por ejemplo el índigo.
Tinción:
Se puede utilizar cualquiera de los métodos de tinción descritos para la piel de las larvas, pero se debe de tener presente que los escleritos se sobrecoloran con facilidad. Por lo general, debido suestructura, las técnicas diferenciales provocan un gran contraste entre las partes. Recomendamos el uso de la solución colorante A y B y la decolorante C. También se puede utilizar una técnica de coloración más suave a base de Vigencial (100 ml), (véase Mef, 2001) y azul de metileno (1 gr) cuya composición completa es la siguiente:
Solución colorante F
Violeta de genciana 5 gr
Etanol 10 ml
Nonoxinol 0,1 gr
Cloruro de benzalconio 0,02 gr
Agua desionizada 80 ml
Azul de metileno 1 gr
Primero introducir los escleritos, durante 2 minutos, en la solución colorante F. Aclarar con agua y decolorar, si es necesario, con esta solución decolorante:
Solución decolorante E
Hipoclorito sódico 6 ml
Agua desionizada 94 ml
Es importante después de usar la solución decolorante aclarar con abundante agua. No se debe abusar de esta solución ni aumentar la proporción de hipoclorito. Éste tiene una potente y eficaz acción aclarante pero puede causar amarilleamiento. Seguidamente colorear durante 1 minuto, agitando lentamente, con una solución de mercuresceína sódica, proporción 1:1000. Si es necesario, decolorar con la solución decolorante C. Para terminar aclarar con agua. Las partes más quitinosas de los escleritos quedarán con diferentes tonalidades azules o moradas y el tejido conjuntivo en gamas rosas o rojos (lám 1, fig.14-21). Esta técnica de doble tinción solo se puede aplicar si se incluyen las preparaciones en medios de montaje que necesitan deshidratación en xileno. Para incluir los escleritos en Euparal, se introducen los mismos durante 1 minuto en orceína acética B. Al término se aclaran con agua y se bañan las partes con la solución colorante B durante 2 minutos. Aclarar con agua y meter nuevamente en la solución de orceína. Fijar con alcohol isopropílico. Para decolorar se puede usar la solución decolorante A (lám 1, fig. 13). Si el medio de inclusión es DMHF , se usará la solución colorante E. Aclarar y limpiar los escleritos de los residuos del negro y volver a teñir durante 2 minutos con la solución colorante A. Se enjuagan con agua y se vuelven a introducir 15 segundos, si es necesario, en la solución colorante E. Si las preparaciones se sobrecoloran, se puede utilizar la solución de limpieza A. Si no se consigue la tonalidad deseada se puede utilizar la solución decolorante D y A y nuevamente D (lám.1, fig. 16). Léase más arriba, al final del apartado I, los comentarios sobre el negro de clorazol.
Medios y métodos de inclusión:
Los escleritos abdominales que se han cortado longitudinalmente, se suelen colocar en el porta en norma ventral, junto a la armadura genital y a la izquierda de la misma. Si éstos son de gran extensión, se ubicarán en el mismo porta pero en otro cubre. Si la armadura genital es de gran espesor y los escleritos no y viceversa, se montarán en cubres separados. Si los escleritos tienen mucho grosor montar las preparaciones en célula de Legendre (fig. 3). Aquellos abdómenes que por su tamaño, no se pudieron seccionar, se montarán en norma dorso-lateral derecha, para que se puedan observar con facilidad los espiráculos. El sistema de almacenamiento en tubos con glicerina, no es muy útil para los escleritos abdominales, puesto que su manipulación resulta engorrosa y es fácil deteriorarlos.
IV. Otras preparaciones
Las preparaciones de patas y tórax, por lo general, no hace falta teñirlas, pero si se da el caso de que son apéndices poco quitinizados, se puede proceder aplicando las técnicas descritas para los escleritos. Las de antenas, no se deben calentar en ninguna solución alcalina, puesto que pudieran perder las lamelas antenales que, en algunas ocasiones, son importantes desde el punto de vista taxonómico. Se limpiarán, si es necesario, con alcohol etílico de 30º. El mismo procedimiento para las preparaciones de alas. Éstas no necesitan tinción. Las preparaciones de escamas es preferible realizarlas en seco. Para montarlas, basta colocar el cubre encima del porta y barnizar los bordes con bálsamo de Canadá, para sellarlos. Si las estructuras son de mucho grosor, es necesario montar en célula seca, para lo cual se procede de la siguiente manera: se baña una junta tórica de P.V.C. transparente de 15 mm de diámetro en una solución de bálsamo de Canadá al 50% en xileno y se deja secar. Se coloca en el centro del porta, se calienta ligeramente y se deja secar, de esta manera la junta tórica quedará pegada. Se colocan dentro las partes a examinar. Se cierra colocando un cubre redondo de 15 mm. Se sellará calentándolo nuevamente, con lo cual el cubre quedará pegado a la junta (fig. 3). Para hacer preparaciones de grosor medio se pueden usar portas excavados. Con respecto a preparaciones de tégulas, palpos labiales, hipofaringes, órganos timpánicos, órganos de Julien, etc., se aplicarán las técnicas descritas para las cápsulas cefálicas, si están muy quitinizados. Si no fuese así, se aplicarán las mismas técnicas de tinción descritas para los escleritos abdominales.
V. Decoloración de estructuras
Un caso bastante frecuente es querer aclarar los tegumentos, para lo cual se utilizará la solución de maceración A y la decolorante A. Si de este modo, no se consigue hacerles todo lo transparentes que se desea, usar la solución de maceración B, donde se dejan varias horas o varios días, dependiendo del tamaño. Pasado el tiempo, se lavan con agua y se introducen en un tubo con ácido acético al 30%. Cuando cesa el desprendimiento de burbujas, se sumergen en el mismo ácido pero puro, durante unos minutos, y se lavan con agua bicarbonatada. Las soluciones aclarantes que usamos, son dos, una de acción suave que es la siguiente:
Solución aclarante A
Ácido fénico 10 gr
Ácido láctico 10 gr
Glicerina bidestilada 30º 20 ml
Agua desionizada 10 ml
La segunda de acción más enérgica:
Solución aclarante b
Hidrato de cloral 66 gr
Ácido fénico 33 gr
Agua desionizada 100 ml
Como aclarantes todavía más potentes, se pueden usar el peróxido de hidrógeno de 110 volúmenes y el hipoclorito sódico, variando su concentración, rebajándolos con agua (anexo VIII). Si se quieren utilizar éstos, es necesario protegerse adecuadamente, puesto que provocan graves y dolorosas quemaduras en la piel (anexo IV, campos F y G).
VI. Comentarios sobre los medios y métodos de inclusión, deshidratación y tinción
Es necesario insistir, como ya se ha comentado a lo largo del trabajo, que no todas las sustancias empleadas para teñir las estructuras son compatibles con todos los medios de inclusión. Con los que necesitan deshidratación de los tejidos, por ejemplo: bálsamo de Canadá, de cedro, hirax, Eukitt, Entellán, parafina, Dpx, etc. los tejidos han de sobrecolorarse, puesto que perderán parte se su tonalidad en el proceso. Como es sabido, para deshidratar, es necesario pasar por diferentes alcoholes hasta llegar al xileno y posterior baño en esencia (clavo o Eugenol, eucaliptol, geraniol, etc.; véase diagrama de procesos, fig. 4). Estos pasos de deben realizar con rapidez hasta llegar al xileno al 50% en etanol, que es cuando los tejidos pierden más color. Sin embargo, una vez superado este paso, se deben dejar reposar los exoesqueletos, ralentizando ostensiblemente el proceso. Si no se hace de esta manera las preparaciones pueden velarse, saliendo manchas turbias. También es posible deshidratar por calentamiento y secado, en cuyo caso la tonalidad no se pierde, pero el tipo de estructuras que aquí se estudian se deforman y encogen, por lo cual no es muy recomendable. Si se deshidratan preparaciones teñidas con Vigencial es preciso hacer el proceso más lentamente, en caso contrario podrían desteñirse en el medio de inclusión. La manipulación de escleritos y de pieles larvales, a la hora de colocarlas en el porta, es relativamente lenta y requiere un medio de montaje que no se seque rápidamente (véase anexo comparativo V). Entellán es muy transparente y aunque, con cierta práctica, se puede conseguir incluir los tejidos sin provocar ni una sola burbuja, con el paso del tiempo las burbujas microscópicas se agrandan, haciéndose visibles. Los portas se limpian con extrema facilidad. Eukitt es casi transparente, se limpia peor y se ha observado que preparaciones con más de 5 años se agrietan ostensiblemente. Hoyer contiene hidrato de cloral y las preparaciones se aclaran con el tiempo. El bálsamo de Canadá, medio de inclusión clásico muy antiguo, con cierta transparencia y que amarillea con el tiempo, para estructuras finas o de mediano grosor es muy adecuado. Permite un periodo de manipulación muy largo y desaloja las burbujas. El amarilleamiento no es problema a la hora de fotografiar las preparaciones, existen en el mercado filtros correctores para los oculares y los objetivos, tanto para el microscopio (o para la lupa estereoscópica) como para la cámara. Los medios de montaje que requieren incluir las estructuras con alcohol, tienen cierta limitación en lo referente a tinción y los problemas de evaporación reseñados en Magro & De La Torre, 2002: 191-192 (véanse tablas comparativas V, VI y VII en ese trabajo). Euparal, resulta muy útil para estructuras que no se pueden deshidratar en xileno y/o aquellas en la que la observación microscópica precisa de grandes aumentos, dado su bajo índice de refracción. Para montar en célula de Legendre (fig. 3) no es muy recomendable. Su color es amarillento y se limpia bien, no desaloja las burbujas. El DMHF, no necesita que las estructuras se deshidraten. Pudiera parecer que presenta grandes ventajas, pero también presenta bastantes inconvenientes. Hay que emplear sustancias cromógenas que no sean hidrosolubles. Se puede teñir con soluciones liposolubles pero éstas son difíciles de eliminar de los tejidos, con la consecuente dificultad a la hora de incluirlas en un medio hidrosoluble. Montar con DMHF escleritos y exoesqueletos larvales que, requieren un largo tiempo de manipulación y operaciones relativas a su correcta ubicación en el porta, es una tarea ardua y difícil. El DMHF se seca en superficie con extrema rapidez a 18º C. Si además, la temperatura es superada por el ambiente o por el calor que genera la pletina de la lupa, se crea una película que a su vez genera gran cantidad de burbujas al colocar el cubre, imposibles o muy difíciles de quitar. El medio no las expulsa. Muchas de las preparaciones quedan pues inservibles si se desean utilizar para la fotografía. Es totalmente transparente y se limpia con facilidad (véase anexo V y VI).
Retoques y tinción puntual:
Se pueden realizar pequeños retoques de coloración realizando un teñido puntual, en una o varias zonas concretas para resaltarlas. Basta colorear manualmente con un pincel del número 00000, con verde o azul, la parte que se desee teñir y fijar. Esta operación, se debe hacer una vez acabada la tinción general y tras el aclarado de la estructura (lám 1, fig. 21). Otra técnica consiste en pintar las zonas que se desean contrastar, con la solución curtiente A. Se debe de partir de estructuras limpias y que no hayan sido teñidas. Dejar secar y hacer un teñido general, por ejemplo, con índigo. En aquellos lugares en que se aplicó el curtiente la tonalidad resultará ligeramente más fuerte que en el resto y además, se decolorarán peor.
Conclusiones
Es bastante frecuente que los entomólogos utilicen un único método de tinción para todo tipo de preparaciones. A nuestro juicio, es más lógico emplear el método de tinción más adecuado al tipo de estructuras a las que se han de aplicar (véase anexo VII). Si las estructuras se quieren fotografiar, las impresiones se deberían realizar antes del montaje en el medio de inclusión. Proceder de esta manera reporta grandes ventajas. Las fotografías obtenidas tendrán más luminosidad, al no tener la necesidad de tomar en cuenta la pérdida de contraste provocada por el color del medio de inclusión, ni su índice de refracción. Por otra parte, las preparaciones resultarán mucho más contrastadas antes de proceder a la deshidratación que, como ya se ha comentado, pierden cierta pigmentación en los sucesivos pasos por alcoholes. También puede suceder que, tras la colocación del cubre, las estructuras se aplasten provocando deformaciones que, en ocasiones, pueden confundirse con caracteres con valor taxonómico, ocasionando no pocos quebraderos de cabeza, a la hora de determinar las especies.
En lo referente a medios de inclusión, mucho se ha hablado de las excelencias del DMHF, al ser un medio soluble en agua que no necesita que las estructuras se deshidraten. Como ya se ha comentado, y no queriendo pecar de insistencia, si no dejar clara constancia del hecho, colocar preparaciones de estructuras grandes, que requieren lentas manipulaciones, con respecto a la ubicación de las mismas en el porta y, además, no crear burbujas, es bastante difícil. Respecto al Euparal, tampoco parece darse demasiada importancia, al hecho de que se evapore y haya que rellenar las preparaciones más gruesas constantemente. Estas manipulaciones, cuando se han de mantener miles de preparaciones, resultan altamente tediosas (y desde el punto de vista económico, costosas), a la par que no vale la pena mantener los portas totalmente limpios, dado que cada vez que se rellenan, se vuelven a manchar. También es muy fácil ensuciar las etiquetas, con la consecuencia, de que es posible perder los datos escritos en las mismas. No digamos, si estas manipulaciones se tienen que realizar con los portas que posea una institución científica, donde se almacenen decenas de miles de preparaciones. En lo referente a Eukkit, se ha constatado, que una vez transcurridos varios años después del montaje, se suele agrietar comenzando por los bordes. Otros medios como por ejemplo: hirax, resina sammar, colofonia, líquido de Faure, líquido de Hoyer y solución Berlèse, tienen innumerables desventajas y han sido superados por otros más modernos, por lo que, a la luz de los resultados de nuestras investigaciones, no recomendamos su uso (véase anexos comparativos V y VI). A la hora de elegir un medio de montaje, habría que delimitar claramente cual va a ser el uso futuro de las preparaciones. Si se van ha observar muy pocas veces y su uso no va a ser intensivo, creemos, que el mejor método es el almacenaje en tubos con solución de glicerina (véase Magro & De La Torre, 2002: 187). A lo sumo, la inclusión en el medio rápido Entellán. Si el uso va a ser intensivo y las preparaciones no muy gruesas, bálsamo de Canadá en porta y cubre. Si las preparaciones son gruesas y de rápida colocación, DMHF, asumiendo las limitaciones en lo referente a las técnicas de tinción y las burbujas. Para finalizar, si las estructuras sólo se pueden deshidratar con alcohol isopropílico, como por ejemplo, la evaginación de una vesica o una bursa expandida, hay que usar Euparal.
Las técnicas para la preparación y montaje de dermotaxias son relativamente sencillas. Basta hacer acopio de los utensilios y las soluciones curtientes, de tinción, decoloración, aclarantes e inclusión expuestas y armarse de una buena dosis de paciencia (véase diagrama de procesos, fig. 4).
El resumen de las técnicas tratadas en este trabajo se presenta en el anexo IX.
Agradecimiento
A Francisco De La Torre a por sus útiles comentarios y correcciones. A Juan Carlos Sánz-Rojo por facilitarnos información sobre el Vigencial y el Eugenol. A José Luis Yela por buscarnos algunas referencias bibliográficas.
Bibliografía
Beck, H. 1960. Die Larvalsystematik der Eulen (Noctuidae). Handlungen zur Larvalsystematik der Insekten, vol. 4. Akademie-Verlag. Berlin.
Beck, H. 1989. Die Bedeutung larvaler (morphologischer und ornamentaler) Untersuchungen für die Systematik der Noctuiden (Lep.). Verhandlungen des IX. Symposium Internationalis Entomofaunistica Europaeae Centralis, Gotha, (1986): 164-172.
Bernis-Mateu, J. 1973. Atlas de microscopia. Ediciones Jover, S.A. Barcelona. 86 pp., 43 lám.
Carayon, J. 1969. Emploi du noir du Chlorazol en anatomie microscopique des insectes. Annales de la Société Entomologique de France, (N.S.), 5(1): 179-193.
Eaton, J. L. 1987. Lepidopteran Anatomy. A Wiley- Interscience Publication. John Wiley & Songs. New York. 257 pp.
Fernández-Rubio, F. 1980. Contribución a la técnica de disección, preparación y tinción de las armaduras genitales (genitalia) de los lepidópteros. Butll. Soc. Cat. Lepid., 28: 11-18.
Fernández-Rubio, F. 1985. Un nuevo modelo de trampa de luz portátil automática para la caza de insectos. Bol. Estac. centr. Ecol. , XIV, nº 28: 91- 102.
Gabe, M. 1968. Tecniques histologiques. Masson, París. VI+1113 pp.
hasenfuss, I., 1963. Eine vergleichend-morphologische Analyse der regulären Borstenmuster der Lepidopteren- larven. Z. Morph. Ökol. Tiere., 52: 197-364.
Hinton, H. E. 1946. On the homology and nomenclature of the setae of lepidopterous larvae, with some notes on the phylogeny of the Lepidoptera. Transactions of the Royal Entomological Society of London, 97: 1-37.
Langeron, M. 1969. Precís de microscopie. 7ème. Édition. Masson et Cie. París. 1430 pp.
Magro, R. & De La Torre, F. 2002. Crítica razonada de los métodos para la preparación de genitalias internas y uso de nuevas sustancias. SHILAP Revta. Lepid. , 30 (118), 2002: 181-201.
Martínez, I. 2002. Técnicas básicas de anatomía microscópicas y de morfometría para estudiar los insectos. Bol. S.E.A., nº 30 (2002): 187-195.
Martoja, R. & Martoja, M. 1967. Initiation aux tecniques de l’histologie animal. Masson et Cie. París. 345 pp.
Mef. 2001. Modificaciones de especialidades farmacéuticas (actualizado en enero del 2001). [Página en línea]. Disponible desde Internet:
<http://www.portalfarma.com/pfarma/taxonomia/ general/gp000024.nsf/ voDocumentos/0EAA6BE57C2EAF2EC1256AD 100302BC1/ $File/pam_modificaciones.pdf> [Con acceso el 20-7-2002].
Pearse, A. 1968. Histochemistry theoretical and Applied. Vol.1.Little, Brown and Company. Boston. 759 pp.
Schauff, M.E. 1986. Collecting and preserving insects and mites: Techniques and tools. [Libro en línea]. Disponible desde Internet: Página principal <http://www.sel.barc.usda.gov/selhome /collpres/collpres.pdf> [Con acceso el 20-7-2002].
Snodgrass, R.E. 1997, actualizado por Schouest, L., Principles of insect morphology. [Libro en línea]. Disponible desde Internet: página principal < http://ag.arizona.edu/classes/ento415/snodgrass/contents.html> [Con acceso el 9-8-2002].
Steinmann, H., & Zombori, L., 1984. A morphological atlas of insectae larvae. Akad. Kiadó, Budapest.
Vives-Moreno, A. 1988. Técnicas de montaje microscópico en el estudio de los lepidópteros.- 1ª Jornada Ibérica de Lepidopterología. Resúmenes: 43. Madrid.
ANEXOS
Anexo I.
Resumen de las soluciones de maceración y oxidantes
|
Solución |
Componente 1 |
Componente 2 |
Base |
|
A |
Hidróxido potásico, 10 gr |
- |
Agua desionizada, 100 ml |
|
B |
Hidróxido potásico, 5 gr |
- |
Agua desionizada, 100 ml |
|
C |
Permanganato potásico, 10 gr |
Alumbre de roca, 10 gr |
Agua desionizada, 80 ml |
|
D |
Hidróxido potásico, 1 gr |
- |
Agua desionizada, 100 ml |
Anexo II.
Resumen de las soluciones de limpieza y curtientes
|
Solución |
Componente |
Base |
|
Limpieza A |
Ácido acético, 35 ml |
Agua desionizada, 65 ml |
|
Curtiente A |
Alumbre de roca, 10 gr |
Agua desionizada, 100 ml |
Anexo III.
Resumen de las soluciones colorantes
|
S. |
Cromógeno1 |
Cromógeno2 |
Componente 1 |
Base |
|
A |
Fuscina básica, 5 gr |
- |
- |
Etanol, 100 ml |
|
A1 |
Hematoxilina, 10 gr |
- |
- |
Etanol, 100 ml |
|
B |
Azul de metileno, 5gr |
- |
- |
Agua desionizada, 100 ml |
|
B1 |
Azul de Toluidina, 5 gr |
- |
- |
Agua desionizada, 100 ml |
|
C |
Índigo, 10 ml |
Bisulfito de sosa, 5 gr |
Etanol (gotas) |
Agua desionizada, 80 ml |
|
D |
Verde He, 10 gr |
Azul de metileno, 10 gr |
Fenol, 2 gr |
Agua desionizada, 100 ml |
|
E |
Negro de clorazol, 0,1 gr |
- |
- |
Agua desionizada, 100 ml |
|
F |
Violeta de genciana, 5 gr |
Azul de metileno, 1 gr |
Etanol, 10 ml |
Agua desionizada, 90 ml |
|
F1 |
Vigencial, 100 ml |
Azul de metileno, 1 gr |
- |
- |
|
F2 |
Vigencial |
- |
- |
Según solución comercial. |
|
G |
Orceína acética B |
- |
- |
Según solución comercial. |
Anexo IV.
Resumen de las soluciones decolorantes
|
Solución |
Componente 1 |
Componente 2 |
Base |
|
A |
Ácido oxálico, 10 gr |
- |
Agua desionizada, 100 ml |
|
A1 |
Bisulfito sódico, 10 gr |
- |
Agua desionizada, 100 ml |
|
B |
Ácido acético, 25 ml |
Etanol, 25 ml |
Agua desionizada, 50 ml |
|
C |
Ácido acético, 2 ml |
Etanol, 78 ml |
Agua desionizada, 20 ml |
|
D |
Hidrato de cloral, 10 gr |
- |
Agua desionizada, 100 ml |
|
E |
Hipoclorito sódico, 6 ml |
- |
Agua desionizada, 94 ml |
|
F |
Peróxido de hidrógeno, 110 Vol. |
- |
- |
|
G |
Hipoclorito sódico, 80 ml |
- |
Agua desionizada, 20 ml |
Anexo V.
Datos comparativos de los medios de inclusión reseñados en este trabajo
.(*) Medios de inclusión no recomendables.
|
Medio de inclusión |
Periodo secado |
Disolución |
Deshidratación |
Transparencia |
Color |
Generación de burbujas |
Limpieza |
|
DMHF |
Muy rápido |
Agua |
No precisa |
Alta |
Incoloro |
Sí, muy fácil |
Fácil |
|
Canadá |
Muy lento |
Xileno |
Precisa |
Media |
Ámbar |
Las desaloja |
Engorrosa |
|
Cedro* |
Muy lento |
Xileno |
Precisa |
Media |
Poco amarillo |
Sí, difícil |
Engorrosa |
|
Sammar* |
Rápido |
Xileno |
Precisa |
Media |
Amarillento |
Sí, fácil |
Engorrosa |
|
Colofonia* |
Rápido |
Xileno |
Precisa |
Baja |
Ámbar oscuro |
Sí, fácil |
Muy engorrosa |
|
Hirax* |
Rápido |
Xileno |
Precisa |
Media |
Muy amarilla |
Sí, fácil |
Muy engorrosa |
|
Eukitt |
Lento |
Xileno |
Precisa |
Media-alta |
Incoloro |
Sí, fácil |
Engorrosa |
|
Entellán |
Rápido |
Xileno |
Precisa |
Muy alta |
Incoloro |
Sí, fácil |
Muy fácil |
|
Euparal |
- |
Alcohol |
Isopropílico |
Media |
Ámbar claro |
Sí, difícil |
Engorrosa |
|
DPX |
Lento |
Xileno |
Precisa |
Media |
Amarillento |
Sí |
Engorrosa |
|
Faure* |
No seca |
Glicerina |
Lactofenol |
Media |
Amarillento |
Sí, difícil |
Fácil |
|
Hoyer* |
No seca |
Glicerina |
Lactofenol |
Media |
Amarillento |
Sí, difícil |
Fácil |
|
Berlèse* |
- |
Ácido acético |
Precisa |
Media |
Amarillento |
Sí |
Engorrosa |
Anexo VI.
Compatibilidades entre técnicas de tinción y medios de inclusión
|
|
Solución |
||||||||
|
Medio |
A |
A1 |
B |
B1 |
C |
D |
E |
F |
F1 |
|
DMHF |
Sí |
No |
No |
No |
No |
No |
Sí |
No |
No |
|
Canadá |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
|
Cedro |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
|
Sammar |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
|
Colofonia |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
|
Hirax |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
|
Eukitt |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
|
Entellán |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
|
Euparal |
No |
No |
Sí |
No |
No |
No |
Sí |
No |
No |
|
DPX |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
Sí |
|
Faure |
Sí |
No |
No |
No |
No |
No |
Sí |
No |
No |
|
Hoyer |
No |
No |
No |
No |
No |
No |
No |
No |
No |
|
Berlèse |
Sí |
No |
No |
No |
No |
No |
Sí |
No |
No |
Anexo VII.
Tinción y partes anatómicas
|
Estructura |
Deshidratación |
Sin deshi-dratación |
|
|
En xileno |
Alcohol isopropílico |
||
|
Cápsula cefálica muy quitinizada |
D è mercuresceína Rebajado |
Orceína B è B è orceína B |
E |
|
Cápsula cefálica poco quitinizada |
D è mercuresceína |
Orceína B è B è orceína B |
E |
|
Esclerito muy quitinizado |
A è B |
Orceína B è B è orceína B |
E è A è E |
|
Esclerito poco quitinizado |
F è mercuresceína |
Orceína B è B è orceína B |
E è A è E |
|
Larva muy quitinizada |
D è mercuresceína |
Orceína B è B è orceína B |
E è A è E |
|
Larva poco quitinizada |
A è B è C |
Orceína B è B è orceína B |
E è A è E |
|
Patas, tégulas, palpos y otros órganos muy quitinizados |
D è mercuresceína Rebajado |
Orceína B è B è orceína B |
E |
|
Patas, tégulas, palpos y otros órganos poco quitinizados |
F è mercuresceína |
Orceína B è B è orceína B |
E è A è E |
|
Órganos timpánicos, Julien, etc |
D è mercuresceína |
Orceína B è B è orceína B |
E |
Anexo VIII.
Resumen de las soluciones aclarantes
|
Solución |
Componente 1 |
Componente 2 |
Componente 3 |
Base |
|
Aclarante A |
Ácido fénico, 10 gr |
Ácido láctico, 10 gr |
Glicerina 30º, 20 ml |
Agua desionizada, 10 ml |
|
Aclarante B |
Hidrato de cloral, 66 gr |
Ácido fénico, 33 gr |
- |
Agua desionizada, 100 ml |
Anexo IX.
Resumen las técnicas desarrolladas en este trabajo
|
TRATAMIENTOS |
|
|
Estructura |
Diagrama de procesos simplificado |
|
Tratamientos alcalinos |
|
|
Piel larval grande o gruesa |
KOH, 15%, 80Cº, 2 min. Ø Agitado 20 veces Ø Gotas alcohol isopropílico Ø Lavado Ø Agitado 20 veces Ø Lavado Ø Agitado 5 veces Ø Lavado |
|
Piel larval pequeña o fina |
KOH, 5%, 80Cº,2 min. Ø Agitado 10 veces Ø Gotas alcohol isopropílico Ø Lavado Ø Agitado 5 veces Ø Lavado |
|
Piel larval muy quitinizada |
Solución A, 1 día * Ø Agitado Ø Lavado solución decolorante A Ø Lavado Ø KOH 30%* ØLavado Ø Ácido cítrico 30% Ø Lavado |
|
Escleritos abdominales grandes de machos o muy gruesos |
KOH,5%, 80C,10 min. Ø Ablación armadura Ø Corte longitudinal Ø KOH,5%,80Cº* Ø Agitado 20 veces Ø Gotas alcohol isopropílico ØLavado Ø Agitado 10 veces Ø Lavado Ø Agitado 5 veces Ø Lavado |
|
Escleritos abdominales pequeños o de hembras o más finos |
KOH,5%,80C,10 min. Ø Ablación armadura Ø Corte longitudinal Ø KOH,5%,80Cº* Ø Agitado 10 veces Ø Gotas alcohol isopropílico Ø Lavado Ø Agitado 5 veces Ø Lavado |
|
Escleritos abdominales con coremata o más delicados |
KOH,5%,80C,8 min. Ø Ablación armadura Ø Corte longitudinal Ø KOH,5%,80Cº* Ø Agitado 5 veces Ø Gotas alcohol isopropílico Ø Lavado ØAgitado 2 veces Ø Lavado |
|
Escleritos abdominales muy pequeños y delicados |
KOH,2%,80C,2 min. Ø Ablación armadura Ø Agitado 5 veces Ø Gotas alcohol isopropílico Ø Aspiración contenido intestinal Ø Agitado 2 veces Ø Lavado |
|
Tratamientos aclarantes |
|
|
Todo tipo, de acción muy suave |
Solución de maceración A* Ø Solución decolorante A* Ø Lavado |
|
Todo tipo, de acción suave |
Solución de maceración A* Ø Lavado |
|
Todo tipo, de acción media |
Solución de maceración A* Ø Solución decolorante A* Ø Solución de maceración B* Ø Lavado Ø Ácido acético 30% Ø Ácido acético puro Ø Lavado en sulfito o bisulfito sódico al 10% en agua Ø Lavado |
|
Todo tipo, de acción fuerte |
Solución de maceración B* Ø Lavado |
|
Todo tipo, de acción muy fuerte (dependiendo disolución en agua) |
1ª Peróxido de hidrógeno 110 Vol.* Ø Lavado |
|
2ª Hipoclorito sódico rebajado* Ø Lavado |
|
|
Tratamientos curtientes |
|
|
Todo tipo, de estructuras |
Solución curtiente A* Ø Lavado |
|
* Tiempo que se estime necesario según estructura y cometido. |
|
|
TRATAMIENTOS |
||
|
Estructura |
Diagrama de procesos simplificado |
|
|
Tinciones generales |
||
|
Piel larval poco quitinizada |
1ª |
Solución colorante A, 18ºC, 4 min. Ø Solución colorante B, 18ºC, 6 min. Ø Limpieza Ø Solución decolorante B*1 Ø Deshidratado |
|
|
2ª |
Solución colorante C, 80ºC, 5 min. Ø Solución curtiente A (solo pasar ) Ø Limpieza Ø Solución decolorante B*1 Ø Deshidratado |
|
Piel larval muy quitinizada |
Solución colorante D, 18ºC, 4 min. Ø Mercuresceína sódica, 18ºC, 1 min. Ø Lavado Ø Solución decolorante C*1 Ø Lavado Ø Deshidratado |
|
|
Piel larval para incluir en medios alcohólicos |
Solución Orceína B, 18ºC, 2 min. Ø Lavado Ø Solución colorante B, 18ºC, 4 min. Ø Solución decolorante A*1 Ø Alcohol isopropílico |
|
|
Piel larval para incluir en medios hidrosolubles |
Solución colorante E, 18ºC, 1 min. Ø Lavado Solución colorante A, 18ºC, 2 min. Ø Solución de limpieza A*1 Ø Solución decolorante D*1 Ø Secado Ø Hidratado |
|
|
Cápsulas cefálicas grandes |
Solución colorante E, 18ºC, 1 min. Ø Lavado Ø Solución colorante A, 18ºC, 2 min. Ø Solución de limpieza A*1 Ø Solución decolorante D*1 Ø Lavado |
|
|
Cápsulas cefálicas pequeñas |
Solución colorante A, 18ºC, 4 min. Ø Solución colorante B, 18ºC, 6 min. Ø Limpieza Ø Solución decolorante B*1 Ø Deshidratado |
|
|
Escleritos abdominales poco quitinizados |
Solución colorante A, 18ºC, 4 min. Ø Solución colorante B, 18ºC, 6 min. Ø Limpieza Ø Solución decolorante C*1 Ø Deshidratado |
|
|
Escleritos abdominales muy quitinizados |
Solución colorante F, 18ºC, 2 min. Ø Lavado Ø Solución decolorante E*1 Ø Lavado Ø Mercuresceína sódica, 18ºC, 1 min. Ø Lavado Ø Deshidratado |
|
|
Escleritos abdominales para incluir en medios alcohólicos |
Solución Orceína B, 18ºC, 1 min. Ø Lavado Ø Solución colorante B, 18ºC, 2 min. Ø Solución decolorante A*1 Ø Alcohol isopropílico |
|
|
Escleritos abdominales para incluir en medios hidrosolubles |
Solución colorante E, 18ºC, 1 min. Ø Lavado Ø Solución colorante A, 18ºC, 2 min. Ø Solución de limpieza A*1 Ø Solución decolorante D*1 Ø Secado Ø Hidratado |
|
|
Tinción puntual |
||
|
Todo tipo de estructuras |
Tinción o doble tinción Ø Lavado Ø Tinción puntual con verde He o azul de metileno Ø Deshidratado |
|
|
Deshidratación |
||
|
Todo tipo de estructuras |
Etanol 50º, 30 segundos Ø Alcohol 70º, 1 min. Ø Etanol puro, 2 min. Ø Xileno 50% en Etanol, 15 min. Ø Xileno, 30 min. Ø Esencia, 1 hora |
|
|
* Tiempo que se estime necesario según estructura y cometido. 1 Proceso a requerimiento u optativo. |
||
Otros temas relacionados disponibles on line en Cve:
Técnicas básicas de anatomía microscópica y de morfometría para estudiar los Insectos
Imelda Martínez M.
http://entomologia.rediris.es/aracnet/9/metodologias/tecnicas/index.htm
La conservación de las arañas
Roberto M. Capocasale
http://entomologia.rediris.es/aracnet/9/metodologias/tecnicas/index.htm
Otros artículos relacionados publicados recientemente por S.E.A.:
Ver: referencias SEA:
http://entomologia.rediris.es/sea/database/referencias/index.htm
Utilización de las agarosas en Entomología
Francisco de la Torre. Bol. S.E.A., nº 31 (2002) : 217–225
http://entomologia.rediris.es/aracnet/10/resumenes