|
Número 2, marzo
de 1999 ARACNET |
| Apuntes sobre Biodiversidad y Conservación de Insectos: Dilemas, Ficciones y ¿Soluciones? | Versión
electrónica del artículo publicado en Bol.SEA, nº 20, monográfico 'Los Artrópodos y el Hombre' (1997, 468 pp.): 25-55, Sociedad Entomológica Aragonesa, Zaragoza (España) |
Fermín MARTÍN PIERA
e-mail: fermin@mncn.csic.es
Museo Nacional de Ciencias Naturales (C.S.I.C.).
Dpto. Biodiversidad y B. Evolutiva.
c/ José Gutiérrez Abascal 2; 28006-Madrid.
Resumen
Introducción
1. La Biodiversidad
2. Medidas de Diversidad
3. Las causas de la Biodiversidad
4. El Paradigma de la Biodiversidad: Los Insectos
5. Conclusiones
6. Una última reflexión sobre los insectos
Referencias
Tras un breve repaso conceptual sobre el significado del término 'Biodiversidad', se revisan algunos aspectos teóricos y metodológicos relativos a la estimación y medida de la diversidad biológica desde una triple perspectiva: ecológica, filogenética y biogeográfica. Seguidamente, se analizan algunos factores ecológicos e históricos que determinan la Biodiversidad y se discute la importancia de los métodos que combinan la información filogenética y biogeográfica, como criterios complementarios de las aproximaciones ecológicas tradicionales, a la hora de diseñar estrategias de conservación fundamentadas en bases científicas. En la última parte del trabajo, se revisan algunos problemas inherentes a la conservación de los insectos. A pesar de los innumerables 'servicios' ecológicos que nos prestan estos organismos, muchas de sus características biológicas (dinámicas metapoblaciones, estacionalidad, variaciones demográficas interanuales, ontogenia y ciclos vitales, adaptaciones ambientales, patrones de comportamiento reproductivos, etc.), invalidan los criterios y procedimientos de conservación que se aplican usualmente a otros organismos. Se argumenta que gran parte de los 'dilemas' planteados por los Insectos, tienen su origen en una severa falta de conocimientos que se va acentuando por el creciente abandono de los estudios entomológicos. El número de especialistas en nuestro país es claramente insuficiente en relación a la diversidad entomológica de nuestro territorio. Se estima que el número actual de entomólogos, habría de incrementarse en un factor de 1,67.
Las líneas que siguen a continuación constituyen una recopilación y ampliación de las ideas expuestas en diferentes conferencias, cursos y seminarios en los que he participado durante los últimos tres años. El mensaje que he transmitido en todos estos foros y que desarrollaré a continuación, es la falta de conocimientos suficientes y rigurosos con los que, generalmente, se afrontan los problemas que plantea la medida, estimación y conservación de la diversidad biológica y, en particular, la del grupo de organismos paradigmático de nuestro desconocimiento de la Biota terrestre: Los Insectos.
Hay tres razones por las que los biólogos estamos interesados en la diversidad y su medida:
1) La diversidad es un concepto intelectualmente muy atractivo que sigue suscitando un considerable debate. A escala ecológica, los bien conocidos patrones de variación espacio-temporal de la diversidad, continúan estimulando la mente de todos cuantos nos dedicamos al estudio de la diversidad biológica, desde cualquier enfoque.
2) Frecuentemente se acostumbra a pensar que las medidas de diversidad son buenos indicadores del estado de ‘salud’ del ecosistema.
3) La diversidad es uno de los temas centrales de la Biología. A escala evolutiva, la explicación de la diversidad constituye la cuestión esencial que intenta explicar el paradigma darwiniano de evolución por selección natural.
Independientemente de la problemática científica y/o conservacionista que plantea el estudio de la diversidad biológica, la diversidad entomológica complica aún más muchos de estos problemas en especial, desde el punto de vista metodológico. El estudio de los insectos evidencia, además, muchas ficciones conservacionistas y no parece aportar soluciones, al menos a corto plazo, dado que los insectos, con demasiada frecuencia, quedan excluidos de muchos de los estudios sobre Conservación de Áreas y Organismos. Sin embargo, no podemos olvidar que el Hombre está dañando la estructura de la diversidad en la Biosfera y los insectos son el componente mayoritario de esta Biodiversidad. Por ello, desde una perspectiva científica no se entiende bien que se excluya a los insectos de los análisis sobre el reparto geográfico, evaluación y conservación de la biodiversidad ya que, generalmente, constituyen la fracción más importante de la diversidad de un territorio.
El trabajo está estructurado en dos grandes bloques. En el primero se revisan algunos aspectos teóricos relativos a la Biodiversidad y su medida a través de diferentes aproximaciones ecológicas, taxonómicas y corológicas (Secciones 1 y 2) y se hace un breve repaso de los factores causales o generadores de diversidad (Sección 3). El segundo bloque, está dedicado a la problemática particular que plantea el estudio y conservación de los insectos, de acuerdo con las características singulares de sus poblaciones, distribución, rareza, ciclos biológicos y megadiversidad (Sección 4).
Mucha gente tiene una idea intuitiva de la diversidad y no tiene ninguna dificultad en aceptar que, por ejemplo, el bosque lluvioso tropical aloja mayor número de seres vivos que un desierto o que existe una alta diversidad de organismos en los arrecifes de coral. Pero ¿qué es la Biodiversidad?, ¿cómo podemos definirla?. A menudo el uso y abuso de un vocablo termina vaciándolo de contenido. Algo parecido comienza a suceder con la Biodiversidad. No han faltado incluso detractores del término. Argumentan que es tal la magnitud conceptual de este neologismo que expresa todo y, al mismo tiempo, nada. Algo hay de razón en ello, pero sólo algo. Así, para Hurlbert (1971) la diversidad es un ‘non-concept’. Para otros es, simplemente, un pseudovocablo cuyos usuarios comparten una definición intuitiva (Salt, 1979). Otros en cambio, algo más moderados, aducen que al menos, no es fácil definirla. Ello se debe a que la diversidad en un contexto ecológico, engloba dos componentes: variedad y abundancia relativa de especies (Magurran, 1988).
En todo caso es innegable que en la última década la palabra ‘Biodiversidad’ parece haber surgido mágicamente llenando el vocabulario de nuestra sociedad a todos los niveles: artículos científicos, proyectos de investigación, cumbres internacionales, medios de comunicación, informes gubernamentales, etc. El uso creciente de este vocablo en la literatura científica, ha sido calificado incluso de dramático (Harper & Hawksworth, 1996). Sin embargo, en Ciencia los conceptos son importantes. Por ello, parece razonable detenerse a reflexionar qué significa exactamente una palabra tan ampliamente usada en los últimos años y no solamente en foros científicos. ¿Es una nueva botella para el vino añejo de las viejas ideas como señalan Harper & Hawksworth (1996) ó nos estamos refiriendo a una cuestión fundamental de la Ciencia?. Más aún, ¿estamos asistiendo al nacimiento de una disciplina emergente, netamente multidisciplinar que denominamos Biodiversidad, o por el contrario, este vocablo es un neologismo vacío de contenido, la nueva etiqueta de otras disciplinas más añejas, con métodos y objetivos propios (Sistemática, Filogenia, Biogeografía, Ecología), con la que acceder a nuevos recursos y seguir haciendo las mismas cosas? (di Castri, 1993). Ambos fenómenos están sucediendo simultáneamente. Como suele suceder en la historia del pensamiento, los nuevos paradigmas conviven durante un tiempo con las viejas ideas.
Fueron Norse y colaboradores (1986) quienes primero generalizaron el término Biodiversidad a tres niveles: diversidad genética dentro de cada especie, diversidad de especies (riqueza ó número de especies) y diversidad ecológica (comunidades). Pero la auténtica explosión del término, aconteció dos años más tarde cuando Wilson (1988) se refirió a la Biodiversidad como el patrimonio o riqueza biótica singular e irrepetible de cada lugar, región ó continente y, en última instancia, de toda la humanidad; el río de la vida del que nos habla Margalef. Nuestro eminente ecólogo hace además una distinción semántica fundamental. Para Margalef diversidad y Biodiversidad no son vocablos sinónimos que expresen conceptos idénticos. La Biodiversidad es el ‘Gran Diccionario de la Vida’, el inmenso caudal de formas presentes y extintas en los que se manifiesta el devenir histórico de la Vida. En cambio, la Diversidad es, en el símil de Margalef, el ‘Lenguaje’ que representa los experimentos de evolución que van enriqueciendo el Diccionario.
Una de las definiciones más ampliamente difundidas es la de McNeely et al. (1990). Según este autor la Biodiversidad es un paraguas conceptual que engloba la variedad de la Naturaleza, incluyendo el número y frecuencia de ecosistemas, especies y genes representados por un conjunto de organismos.
Ahora bien, a pesar de toda esta reciente efervescencia teórica, cabe preguntarse si no estaremos poniendo de moda uno de los problemas más clásicos y fundamentales de la Biología, tal vez el problema central; me he referido a ello anteriormente en la Introducción (ver punto 3). En efecto, creo que la respuesta más general y sencilla a la pregunta inicial (¿qué es la Biodiversidad?), no es otra que la que emana de la propia Teoría Evolutiva: La diversidad biológica es el resultado más genuino del proceso evolutivo, que se manifiesta a todos los niveles jerárquicos de la vida: de las moléculas a los ecosistemas, pasando por los genes, las células, los individuos, las poblaciones y las comunidades (Solbrig, 1991 a y b). Es, como ya he repetido, el problema esencial que afronta Darwin (1859) en su famoso libro, ‘Del origen de las especies por selección natural...’. Descendencia con variación, mutación y selección son, en términos ortodoxos, las causas que determinan la cantidad de seres vivos que existen en un tiempo y espacio determinados. Esta perspectiva histórica es la que manifiesta en toda su dimensión, la característica esencial del estado singular de la materia que denominamos Vida: el hecho de ser diversa, variable y variada.
En todos los conceptos y definiciones de Biodiversidad, convergen dos dimensiones estrechamente relacionadas que dependen de la escala de enfoque y de la escala de análisis (genes, individuos, poblaciones, especies, comunidades, ecosistemas): la histórico-evolutiva y la ecológico-funcional. La primera se consagra al estudio de los Patrones estructurales y espacio-temporales en los que se expresan las relaciones genealógicas de los organismos, ilustradas en las clasificaciones jerárquicas y la segunda, a los Procesos e interrelaciones funcionales que acontecen en la intimidad de los propios organismos y en el seno de los ecosistemas.
Si aceptamos que la diversidad es una
propiedad de los seres vivos y, por tanto, algo más que el número de especies en un
tiempo y lugar, hemos de plantearnos cómo medirla. Es indudable que sin una
cuantificación de la diversidad biológica no podremos movilizar una ciencia seria y
rigurosa de la Biodiversidad. Además, a menudo necesitamos diferentes aproximaciones
metodológicas (medidas) para resolver problemas de distinta índole. Por ejemplo, para
establecer una red de reservas naturales que alojen la mayor diversidad posible en el
mínimo número de áreas protegidas, precisaremos medidas de diversidad espacial (![]() /ß/
/ß/![]() -diversidad) y
aproximaciones que combinen la información filogenética y biogeográfica. En cambio, si
nuestro objetivo es investigar la importancia funcional de una o varias especies en un
ecosistema degradado, en franco retroceso, con especies en peligro de extinción, nuestra
investigación tendrá que dirigirse a conocer las relaciones funcionales de las especies
en el seno del ecosistema, averiguar cuál es el estado de los procesos ecológicos que
tienen lugar y si es posible la aplicación de medidas que permitan la inversión del
proceso de regresión, hasta la restauración de las interrelaciones funcionales
originales.
-diversidad) y
aproximaciones que combinen la información filogenética y biogeográfica. En cambio, si
nuestro objetivo es investigar la importancia funcional de una o varias especies en un
ecosistema degradado, en franco retroceso, con especies en peligro de extinción, nuestra
investigación tendrá que dirigirse a conocer las relaciones funcionales de las especies
en el seno del ecosistema, averiguar cuál es el estado de los procesos ecológicos que
tienen lugar y si es posible la aplicación de medidas que permitan la inversión del
proceso de regresión, hasta la restauración de las interrelaciones funcionales
originales.
En todo caso, las dimensiones ecológica y evolutiva de la diversidad biológica proporcionan los marcos teóricos y metodológicos de referencia, en los que desarrollar medidas adecuadas para resolver las numerosas cuestiones que plantea en la actualidad, los problemas relativos a la conservación y preservación de la Biodiversidad. Aunque la Ecología es una ciencia biológica más joven que las clásicas disciplinas evolutivas (Sistemática, Filogenia, Biogeografía), paradójicamente, las medidas ecológicas tienen una larga tradición histórica, en comparación con las medidas evolutivas, las cuales, apenas tienen diez años de desarrollo intelectual.
|
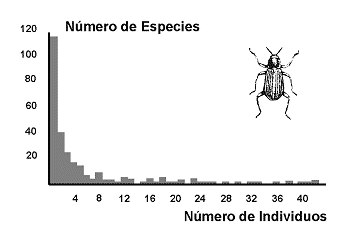
Figura 1. Distribución de abundancia en una comunidad de coleópteros del río Támesis. Modificado de Magurran (1988). Datos de Williams (1964). |
2.1. Medidas Ecológicas de Diversidad
En el sentido ecológico más estricto la diversidad - un concepto derivado de la Teoría de la Información - es una medida de la heterogeneidad del sistema, es decir, de la cantidad y proporción de los diferentes elementos que contiene. Además del significado que en sí misma tiene la diversidad, es también un parámetro muy útil en el estudio, descripción y comparación de las comunidades ecológicas. Dado que la diversidad en una comunidad es una expresión del reparto de recursos y energía, su estudio es una de las aproximaciones más útiles en el análisis comparado de las comunidades, o incluso de regiones naturales (Halffter & Ezcurra, 1992).
De todos los índices descritos en la literatura, los dos más clásicos son el Índice de Simpson y el Índice de Shanon-Wienner. El primero es una medida de Dominancia y se expresa como:
![]() =
= ![]() pi2
pi2
siendo pi = ni /N, donde ni es el número de individuos de la especie ‘i’ y N es la abundancia total de las especies. Con otras palabras, pi es la abundancia proporcional de la especie ‘i’.
A medida que el índice se incrementa,
la diversidad decrece. Por ello el Índice de Simpson se presenta habitualmente como 1/![]() =
1/
=
1/![]() pi2 que expresa, en realidad, una medida de la
dominancia, como se acaba de indicar. Por tanto, el índice de Simpson sobrevalora las
especies más abundantes en detrimento de la riqueza total de especies.
pi2 que expresa, en realidad, una medida de la
dominancia, como se acaba de indicar. Por tanto, el índice de Simpson sobrevalora las
especies más abundantes en detrimento de la riqueza total de especies.
El Índice de Shannon-Wienner, a veces incorrectamente denominado Índice de Shannon-Weaver (Krebs, 1985), procede de la Teoría de la Información y se expresa como:
H’ = - ![]() pi
ln pi
pi
ln pi
Otro de los índices más difundidos es el Índice de Margalef (1958):
Dmg = (S-1)/ln N
|
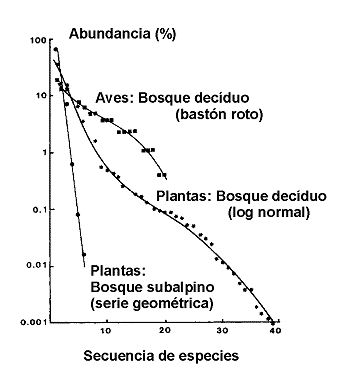
Figura 2. Curvas de abundancia de especies ilustrativas de tres modelos de distribución: 'bastón roto', log normal y serie geométrica. Modificado de Magurran (1988). Datos de Whittaker (1970). |
Estos índices pueden derivarse de los denominados números de diversidad de Hill (Ludwig & Reynolds, 1988). El método de Hill permite ordenar estos índices de acuerdo a su tendencia a sobrevalorar bien la riqueza de especies (dando más ‘peso’ a las especies menos abundantes y poco comunes o raras), o bien, la dominancia, es decir, dando mayor énfasis a las especies más abundantes. Hill (1973) propuso un método elegante para describir las relaciones entre todos estos índices, definiendo un índice de diversidad como la abundancia proporcional media recíproca y fue capaz de clasificarlos de acuerdo al peso que cada uno de ellos otorgaba a las especies más raras:
Na = (p1a + p2a + p3a +....+ pna)1/(1-a)
Na Na es al a orden de diversidad y pn es la abundancia proporcional de la especie de orden n.
Si a = 0; N0 = S número de especies totales en la comunidad.
Si a = 1; N1 = e H’
Si a = 2; N2 = 1/![]() = 1/ pi2.
= 1/ pi2.
Siempre será cierto que N0 > N1 > N2.
En el primer caso todas las especies, incluso las raras, son igualmente pesadas. En el segundo se pesan las especies abundantes y, en el tercero, las especies muy abundantes.
El otro parámetro descriptivo de las relaciones de abundancia, es la Equitatividad. La equitatividad también se puede medir de muchas formas. Una de las más sencillas es estimarla a partir de la abundancia de la especie dominante:
E = 1/sp1
No obstante, una de las más frecuentes es la razón que expresa la equitatividad como la diversidad H’ (encontrada) con relación al máximo valor que H’ puede alcanzar cuando todas las especies muestran idénticas abundancias; es la familiar ‘J’ de Pielou (1975, 1977):
E = H’/Hmax = H’/lnS
Para un desarrollo más extenso de los indices de diversidad, dominancia y equitatividad, el lector interesado puede consultar cualquier texto de Ecología general. Por su claridad y amplitud resultan muy recomendables los de Magurran (1988) y Ludwig & Reynolds (1988). Son igualmente recomendables algunos artículos que tratan con profundidad diferentes aspectos y problemas relativos a la medida ecológica de la diversidad; por ejemplo, Alatalo (1981) en lo que se refiere a índices de equitatividad.
Por su mayor complejidad, no se trata aquí el tema de la estimación de la riqueza de especies. No obstante, merece la pena citar tres artículos de síntesis que tratan en detalle, con claridad y rigor este interesante tema: Hetlshe & Forrester (1983), Baltanás (1991) y Colwell & Coddington (1994).
|
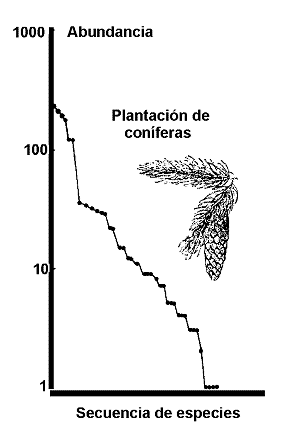
Figura 3. Curva de abundancia de especies en una plantación de coníferas de Irlanda. Modificado de Magurran (1988). |
2.1.1. Modelos de distribución
Las especies se distribuyen, normalmente, según jerarquías de abundancia desde algunas especies muy abundantes hasta algunas muy raras. Generalmente, en las comunidades lo normal es que haya bastantes especies raras, pocas especies abundantes y muchas especies con una abundancia intermedia (Figura 1). Esta parece una regla que también se cumple en las sociedades humanas: hay bastantes personas pobres, pocas muy ricas y mucha clase media. Es muy probable que este tipo de relación especies/abundancia, se dé siempre que los elementos del sistema interaccionan y compiten por unos recursos limitados. Esta observación condujo a los modelos de distribución de abundancia de especies.
Se han descrito cuatro modelos principales: Las series logarítmicas (log-series) de Fischer, Corbet & Williams (1943), el modelo lognormal (Preston, 1948), las series geométricas y el denominado modelo de ‘bastón roto’ (MacArthur, 1957). Como se aprecia en la figura 2, hay una progresión desde el modelo geométrico con unas pocas especies muy abundantes y las restantes muy raras y escasas a través de las log-series y la distribución log-normal, en las que las especies con abundancias intermedias son las más comunes hasta el modelo en bastón roto en el que casi todas las especies son igualmente abundantes. Estos cuatro modelos se han interpretado clásicamente en términos de distribución de recursos, en donde la abundancia de una especie es, de alguna forma, equivalente a la porción de nicho ocupado por cada especie en la comunidad.
Me centraré únicamente en las dos primeras por ser las que explican la mayor parte de los datos experimentales.
El modelo de series logarítmicas de Fisher, Corbet & Williams representó el primer intento de describir matemáticamente la relación entre el número de especies y el número de individuos que representan a cada una de ellas. Williams, un lepidopterólogo que trabajó en el archipiélago malayo, planteó a Fischer la siguiente cuestión: Conociendo cuantas especies se habían colectado y la abundancia de cada una de ellas y aceptando que la colección de Williams no contuviera todas las mariposas ¿sería posible estimar cuántas especies no habían sido recogidas por Williams, considerando su colección como una muestra aleatoria de la fauna de mariposas del archipiélago y conociendo la distribución estadística de las abundancias?. Aunque la matemática asociada al problema es relativamente complicada, el enfoque de Fisher para resolverlo, fue realmente sencillo. Fisher construyó un diagrama en el que representó el número de individuos, frente a la cantidad de especies representadas en cada clase de abundancia. La figura 3 muestra un ejemplo de distribución de abundancia que sigue el modelo de la serie logarítmica.
|
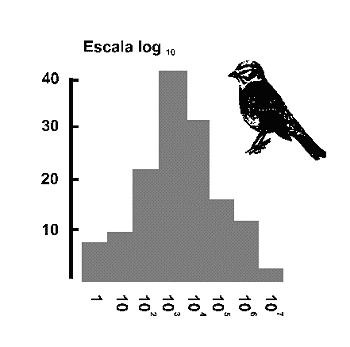
Figura 4. Distribución Log normal. Las clases de abundancia (eje 'X') se representan en incrementos de orden de magnitud 1, 10, 100. 1000, 10000... La elección de logaritmos en base 10, es más apropiada para extensas serires de datos como en el ejemplo que se indica, que corresponde a la diversidad de aves en Gran Bretaña (Williams, 1964). El eje 'Y' muestra el número de especies en cada clase de abundancia. Modificado de Magurran (1988). |
Como indican Halffter & Ezcurra (1992), en el momento que Fisher, Corbet & Williams propusieron el modelo, la mayor parte de la comunidad científica interpretó el trabajo como un divertimento académico. ¿A quién le interesa estimar el número de especies que no conoce?. La perspectiva parecía casi metafísica. La relevancia del modelo de las series logarítmicas, reside en que es capaz de predecir la cantidad de especies en una muestra, conociendo la cantidad de individuos que tiene cada especie en la muestra y sumando los individuos de todas las especies, como una función del tamaño total de la muestra.
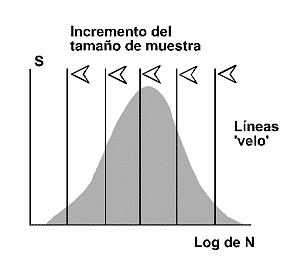
El desarrollo de Fisher y colaboradores, pronto llamó la atención de un ingeniero inglés radicado en Pensilvania, Frank Preston. El modelo de Preston (1948) o modelo lognormal predice que la cantidad de especies presentes en una comunidad tendrá una relación Gausiana o Normal con el logaritmo de la abundancia1 (Figura 4). La mayoría de las comunidades estudiadas por los ecólogos, muestran un patrón de distribución de especies-abundancia del tipo log normal. Como es bien sabido, la distribución log normal es simétrica, en forma de campana. Asimismo, estimas repetidas de los índices de diversidad muestran una distribución lognormal (Magurran, 1988). Sin embargo, si los datos como es frecuente, derivan de una muestra finita, la parte izquierda de la curva que representan las especies más raras de la comunidad (las que no se recogen habitualmente en las muestras), está oculta. Es decir, los datos reales se ajustan, por lo general, a una distribución log normal truncada (Figura 5). Cuanto más pequeña es la muestra, más desplazada hacia la derecha de la ‘moda’ se sitúa la que Preston denominó ‘veil-line’. Sólo conocemos la porción de la curva a la derecha de esta línea, el resto de la distribución a la izquierda de dicha línea, queda oculta por la ‘veil line’ (Figura 6). A medida que se incrementa el tamaño de la muestra, la ‘línea velo’ se desplaza hacia la izquierda mostrando, en primer lugar, el valor modal de la curva y, eventualmente, la distribución log normal completa. Esto únicamente sucede en colecciones de datos que cubren un amplio rango geográfico.
|
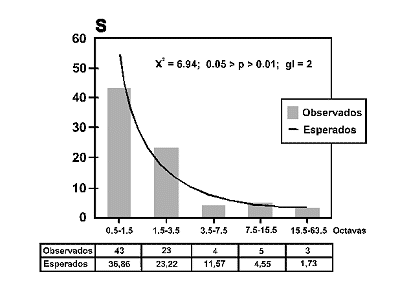
Figura 5. Distribución de frecuencias por clases de abundancias u Octavas en una comunidad coleopterológica tropical (Serranía de Chiribiquete; Caquetá, Colombia), S: Número de especies en una octava. La tabla muestra los valores observados y esperados según predice la distribución log normal (truncada). Datos de Martín Piera y Fernández Torres (1996). |
Figura 6. Distribución log normal. en muestras pequeñas únicamente es visible la porción de la distribución a la derecha de la moda. A medida que se incrementa el tamaño de la muestra, la línea 'velo' se mueve de izquierda a derecha descubriendo la moda y, eventualmente, la distribución log normal completa. S: número de especies. Log de N: logaritmo de la abundancia. Modificado de Magurran (1988). |
Una de las consecuencias más importantes del modelo log normal de Preston es que al igual que el modelo de la log-serie de Fisher, es capaz de describir la cantidad de especies que se encuentran en un área, conociendo la cantidad de individuos en el total de la muestra. La diferencia reside en que el modelo de Fisher predice un rango muy amplio de curvas especies-área, en cambio el modelo de Preston predice una relación del tipo:s = k Az donde ‘k’ y ‘z’ son coeficientes derivados del modelo; ‘k’ es una constante que depende del tipo de organismos y ‘z’ es la pendiente de la recta que toma un valor muy cercano a 0,23 en muestras relativamente grandes y próximo a 0,25 en muestras pequeñas; ‘s’ es el número de especies y ‘A’ el tamaño del área.
|
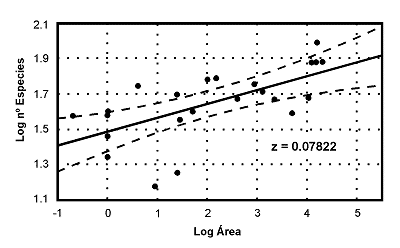
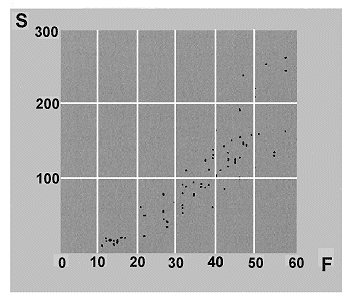
Figura 7. Relación especies-área en comunidades ibéricas de Escarabeidos coprófagos (Coleoptera): Scarabaeidae, Aphodiinae y Geotrupinae. Nótese que el valor del exponente 'z' se sitúa muy por debajo del valor habitual (0.23): z=0.07822. Cortesía de Jorge M. Lobo. Datos de 25 estudios ibéricos. |
Muchos investigadores se dedicaron a poner a prueba las ideas de Preston, a través del sencillo procedimiento de representar en escala logarítmica el área de una muestra con relación al número de especies contenidas en ella. Se ha encontrado que, con asombrosa regularidad, aparecían rectas con pendientes cercanas al valor predicho por Preston (z = 0,23) y pendientes algo mayores en islas muy depauperadas o en comunidades muy empobrecidas en especies. No obstante en algunos grupos de coleópteros de biología muy particular, como los escarabeidos coprófagos, los valores del exponente ‘z’ encontrados son muy bajos. En muy pocas ocasiones, se han obtenido los que predice el modelo de Preston (Figura 7). La interpretación más plausible es que las comunidades de Scarabaeidae coprófagos en la Península Ibérica, se encuentran saturadas de especies y en ellas, apenas existe el carácter de ‘insularidad’. Se trata además de un grupo de organismos, en el que, frecuentemente, se encuentra un patrón de distribución de especies-abundancia que no se ajusta a una distribución log normal sino bimodal.
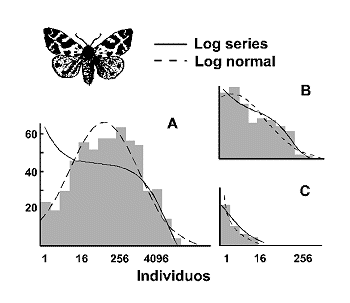
Antes de terminar con el tema de los modelos de distribución de especies-abundancia, ha de comentarse que muchos datos pueden describirse igualmente con ambos modelos: log series y log normal y, en ocasiones, resulta difícil decidir cual de los dos se ajusta mejor a nuestros datos. La figura 8 muestra que cuando los datos se ajustan a una distribución log normal truncada, es casi indistinguible de la serie logarítmica.
|
Figura 8. Log series y distribución log normal refereidas a datos de diversidad en mariposas nocturnas. A: Abundancia de mariposas en 255 localidades de Gran Bretaña. B: Muestra anual típica en una localidad rural. C Muestra de una localidad urbana muy empobrecida. Modificado de Magurran (1988); datos de Taylor (1978). |
Figura 10. Variación de la alfa, beta y gamma diversidad en comunidades de Scarabaeoidea coprófagos del Parque Nacional de Doñana. S: Número de especies. Beta: Índice de diversidad ß de Whittaker (1960). Gamma diversidad representada como la curva de riqueza acumulada. Datos de Sanmartín, Lobo & Martín Piera (1998). |
|
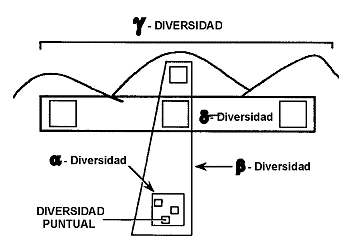
Figura 9. Jerarquía espacial de la
diversidad. Diversidad puntual: unidad espacial completamente censada una o varias veces. |
2.1.2. La Jerarquía Espacial de la Diversidad
Tal vez la estima más generalizada de
diversidad es la riqueza de especies: la popular ![]() -diversidad. Según Whittaker (1960 y
1975) se precisan, al menos, dos medidas adicionales para determinar la diversidad: la
diferencia entre comunidades a lo largo de un gradiente del hábitat
(‘Turnover’) (ß-diversidad) y la diferencia entre áreas a escala
geográfica (
-diversidad. Según Whittaker (1960 y
1975) se precisan, al menos, dos medidas adicionales para determinar la diversidad: la
diferencia entre comunidades a lo largo de un gradiente del hábitat
(‘Turnover’) (ß-diversidad) y la diferencia entre áreas a escala
geográfica (![]() -diversidad). Es la que algunos autores han denominado
jerarquía espacial de la diversidad (McNaughton, 1995) (Figura 9).
-diversidad). Es la que algunos autores han denominado
jerarquía espacial de la diversidad (McNaughton, 1995) (Figura 9).
La diversidad-![]() , es una
función de la cantidad de especies presentes en un mismo hábitat y es el componente de
la Biodiversidad más importante y más comúnmente citado en las selvas tropicales
húmedas y en los arrecifes coralinos. La ß y
, es una
función de la cantidad de especies presentes en un mismo hábitat y es el componente de
la Biodiversidad más importante y más comúnmente citado en las selvas tropicales
húmedas y en los arrecifes coralinos. La ß y ![]() -diversidad son tan
importantes como la riqueza a la hora de determinar la diversidad local y regional. La ß-diversidad
es una medida del relevo faunístico (‘turnover’) a lo largo de un gradiente:
entre muestras de un mismo hábitat, entre hábitats o entre hábitats a medida que se
amplía el rango geográfico (
-diversidad son tan
importantes como la riqueza a la hora de determinar la diversidad local y regional. La ß-diversidad
es una medida del relevo faunístico (‘turnover’) a lo largo de un gradiente:
entre muestras de un mismo hábitat, entre hábitats o entre hábitats a medida que se
amplía el rango geográfico (![]() -diversidad). Cuanto menor es el número de especies compartidas entre dos
muestras, hábitats, regiones, es decir, cuanto mayor es el relevo faunístico
(complementariedad), mayor es la ß-diversidad. La
-diversidad). Cuanto menor es el número de especies compartidas entre dos
muestras, hábitats, regiones, es decir, cuanto mayor es el relevo faunístico
(complementariedad), mayor es la ß-diversidad. La ![]() -diversidad es la riqueza
de especies a lo largo de un rango de hábitats (diversidad regional) y puede medirse como
la curva de riqueza acumulada (Figura 10), o bien, como el
producto:
-diversidad es la riqueza
de especies a lo largo de un rango de hábitats (diversidad regional) y puede medirse como
la curva de riqueza acumulada (Figura 10), o bien, como el
producto: ![]() =
= ![]() x ß x
Número de hábitats (ecosistemas; unidades paisajísticas, etc.).
x ß x
Número de hábitats (ecosistemas; unidades paisajísticas, etc.).
|
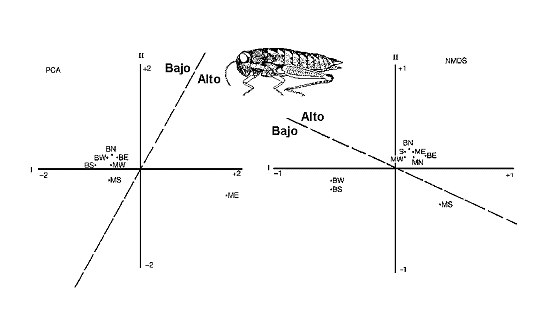
Figura 11. Análisis de comunidades de ortópteros en una reserva sudafricana, aplicando dos métodos de ordenación: Análisis de Componentes Principales (PCA) y un método no paramétrico (NMDS: ‘non metric multidimensional scaling’). PCA agrupa seis estaciones con densidades bajas de ortópteros en tanto que NMDS, agrupa seis estaciones con altas densidades. Las siglas representan estaciones de muestreo. Modificado de Samways (1994). Datos de Samways (1990). |
La expresión original de Whittaker
(1960) es ßW = S/![]() - 1, donde ‘S’ es el
número total de especies en la comunidad y ‘
- 1, donde ‘S’ es el
número total de especies en la comunidad y ‘![]() ’
es el promedio de especies en todos los hábitats considerados. Realizando este mismo
cálculo entre pares de hábitats contiguos, obtenemos la medida del reemplazamiento
faunístico a lo largo de todo el transecto analizado.
’
es el promedio de especies en todos los hábitats considerados. Realizando este mismo
cálculo entre pares de hábitats contiguos, obtenemos la medida del reemplazamiento
faunístico a lo largo de todo el transecto analizado.
Cody (1975) se interesó más por el cambio en la composición de la comunidad, a lo largo de un gradiente del hábitat. Por ello su expresión toma en cuenta el número de especies singulares, no compartidas, entre cada hábitat. La expresión de Cody es:
ßC = g(H) + l(H)/2
siendo g(H) el número de especies ganadas y l(H) el número de especies perdidas a lo largo del transecto.
2.2. Medidas Evolutivas de Diversidad
Como acabamos de ver, la literatura está plagada de índices que miden la diversidad de las comunidades. Unos han tenido mayor aceptación que otros, pero todos han tratado de expresar en un único valor numérico, la riqueza y la dominancia/equitatividad de las comunidades en estudio. No es que el intento haya sido vano, pero tal vez sí algo pretencioso y demasiado simplista.
Se ha querido encontrar un índice que exprese la complejidad de los ecosistemas con una sola cifra y permita, además, hacer comparaciones entre diferentes lugares y/o entre distintas comunidades. Desafortunadamente no pasan de ser meros números, con poco o nulo valor conceptual. De hecho, en algunos casos se puede obtener el mismo valor de diversidad con diferentes combinaciones de valores de riqueza, abundancia y equitatividad (e.g. C2, C4 y C5 en la Tabla1) y lo que es aún peor, una comunidad con gran riqueza de especies pero desigual distribución de abundancia, tendrá valores de diversidad menores que otra pobre en especies, pero con una alta equitatividad (e.g. C1 y C3 en la Tabla 1).
Tabla 1
Variación del índice de Diversidad H’
(Shannon-Wienner) en comunidades hipotéticas (C1.... C5). N:
Abundancia. Sp1.... Sp11 especies.
| Sp1 | Sp2 | Sp3 | Sp4 | Sp5 | Sp6 | Sp7 | Sp8 | Sp9 | Sp10 | Sp11 | N | H’ | |
| C1 | 2 | 2 | 2 | 6 | 1,099 | ||||||||
| C2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 18 | 2,197 | ||
| C3 | 90 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 100 | 0,555 |
| C4 | 20 | 20 | 8 | 8 | 8 | 8 | 8 | 5 | 5 | 5 | 5 | 100 | 2,250 |
| C5 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 5 | 5 | 100 | 2,372 |
Por otro lado, diferentes índices proporcionan diferentes resultados, utilizando los mismos datos. Incluso las técnicas más complejas de análisis multivariante (PCA - Análisis de Componentes Principales -, NMDS - ‘Non-metric multiple dimensional scaling’ -, Análisis de Correspondencia, Análisis Canónico, ‘Twispan’, etc.) pueden dar resultados que sugieren interpretaciones diferentes. En el ejemplo que muestra la figura 11, PCA agrupa los sitios con menores densidades de ortópteros en tanto que NMDS, el otro método, agrupa los de mayor densidad.
Las medidas de diversidad de cualquier tipo, tampoco nos dicen nada acerca de las relaciones funcionales de los organismos en el seno de los ecosistemas ni de la respuesta a las condiciones cambiantes del medio. El punto crucial del actual problema de perdida global de diversidad, no es sólo qué hay, dónde se encuentra, cómo se estructura, sino también qué está pasando a tenor de los cambios a pequeña y gran escala en la superficie y en la atmósfera del planeta.
Hay dos extremos de equivalencia funcional: 1) Cada especie en el ecosistema juega un papel relativo importante, de tal manera que la desaparición de cada especie debilita la integridad del ecosistema (‘Hipótesis del Remache’). El símil que plantea esta hipótesis supone que cada especie representa algo similar a los ‘remaches’ de los antiguos aeroplanos. A medida que ‘el viejo aeroplano pierde remaches’ aumenta el peligro de que su estructura se debilite hasta no poder volar. En términos ecológicos esto equivale a decir que cada especie, ocupa un nicho ecológico único e irremplazable. 2) El ecosistema está compuesto de grupos funcionales parcialmente redundantes, cada uno con especies ecológicamente equivalentes. De esta forma, podríamos perder algunas especies sin que se resienta el ecosistema en su conjunto (Hipótesis de las especies redundantes).
Así por ejemplo, en las comunidades de escarabeidos coprófagos, grupo de coleópteros muy diversificado, especialmente en el continente africano, se han descrito hasta siete grupos funcionales (Doube, 1991; figura 12). Es muy probable que la pérdida por extinción, migración, o cualquier otra causa, no afecte sensiblemente a la estructura y funcionalidad de la comunidad, así como a su participación en los flujos de materia y energía que tiene lugar en el microecosistema excremento; pero en todo caso, habría de demostrarse.
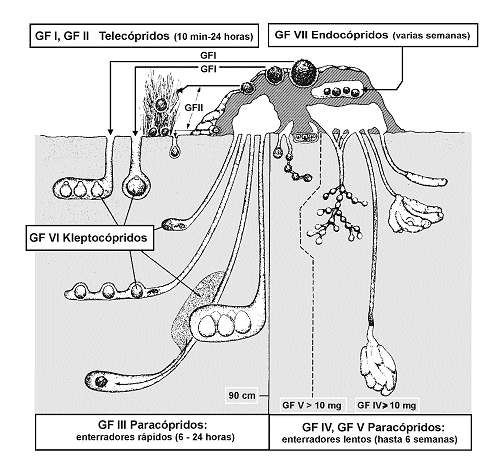 Fig. 12. Representación esquemática de grupos funcionales (GF) en Scarabaeoidea (Col.) coprófagos. Modificado de Doube (1990). |
Como han señalado Chapin et al., (1992), probablemente la realidad se encuentra en algún punto intermedio de estos extremos. Precisamente uno de los retos de la Conservación es predecir si existen especies que constituyen auténticas ‘piedras angulares’ del ecosistema. Es decir aquellas especies claves, no redundantes desde el punto de vista funcional que juegan un papel esencial en la integridad del sistema.
En suma, la distribución de la riqueza en categorías de abundancia, los índices de diversidad, los modelos de dominancia-abundancia, los análisis multivariantes son todos ellos métodos descriptivos, pero ninguno explica los patrones de diversidad y sus causas. Y lo que es aún más importante, tratan a todas las especies de igual manera; no hay diferencias taxonómicas (evolutivas) ni funcionales. Actualmente, sin embargo, tanto ecólogos como conservacionistas coinciden en la necesidad de tomar en consideración los patrones y procesos históricos que determinan el grado de diferencia taxonómica entre los organismos a la hora de explicar las causas que determinan la diversidad (IUCN, 1990; Cornell & Lawton, 1992; Grombridge, 1992; Haydon et al., 1993; Pearson & Juliano, 1993; Farrell & Mitter, 1993; Brooks & McLennan, 1991 y 1993; Cadle & Greene, 1993; Valkenburg & Janis, 1993; Ricklefs & Schluter, 1993; Lobo, 1998).
Tres nuevas aproximaciones se han sugerido a lo largo de esta década para cuantificar la singularidad taxonómica (‘distinctiveness’) o grado de independencia en la historia evolutiva de un taxon particular (IEH: ‘independent-evolutive-history’) (May, 1996).
i ) Medidas Moleculares (Embley et al., 1996).
ii) Medidas expresadas en términos de Riqueza Taxonómica
iii) Medidas Filogenéticas.
A continuación me referiré a las dos aproximaciones con las que estoy más familiarizado; las dos últimas, especialmente la tercera. Antes quisiera hacer una breve disgresión conceptual que conviene tener siempre presente cuando trabajamos con estimaciones fundamentadas en una visión taxonómica de la diversidad: me refiero al concepto de especie.
Los múltiples conceptos de especie en diferentes grupos e incluso dentro del mismo grupo de organismos, son una causa importante de incertidumbre inherente a todos los aspectos de la investigación sobre biodiversidad que utilizan la especie como ‘unidad estándard’. Si la unidad de medida es variable, las conclusiones basadas en ella han de tomarse con precaución. El concepto biológico de especie se ha utilizado como una entidad comparable en diferentes organismos, pero esta comparación no siempre es posible entre organismos evolutivamente muy dispares. ¿Cómo se compara, por ejemplo, un insecto y un hongo cuando se examinan con métodos moleculares o filogenéticos? ¿cuál es la fiabilidad de las múltiples especies definidas únicamente mediante ejemplares preservados en colecciones?, ¿cómo aplicar el concepto biológico de especie a organismos que nunca han experimentado reproducción sexual?. Conviene meditar y tener siempre presente estas cuestiones.
2.2.1. Diversidad Taxonómica
Como ya he indicado, la estima más
generalizada de diversidad es la riqueza de especies, la popular ![]() -diversidad.
Ahora bien, a medida que se incrementa el número de especies, cabe esperar que,
paralelamente, se incremente la presencia de grupos taxonómicos divergentes de alto
rango. Se discute si el número de taxones de alto rango, pueden proporcionar una medida
de diversidad más apropiada que el número de especies. En efecto, desde una perspectiva
estrictamente conservacionista, cabe preguntarse si el número de Clases, Ordenes,
Familias, ..., presentes en un área, es una estima conveniente y rápida del número de
especies. La pregunta tiene profundas implicaciones prácticas si tenemos en cuenta la
ingente cantidad de trabajo taxonómico descriptivo que aún queda por hacer en extensas
regiones del Planeta, especialmente en las áreas tropicales. En efecto, si esta relación
fuera de carácter universal, podríamos ‘subrogarnos’ a estos taxones
superiores, para obtener estimas prácticas y rápidas de diversidad, sin esperar a
concluir el Inventario exhaustivo de especies. No obstante, los datos no son concluyentes.
-diversidad.
Ahora bien, a medida que se incrementa el número de especies, cabe esperar que,
paralelamente, se incremente la presencia de grupos taxonómicos divergentes de alto
rango. Se discute si el número de taxones de alto rango, pueden proporcionar una medida
de diversidad más apropiada que el número de especies. En efecto, desde una perspectiva
estrictamente conservacionista, cabe preguntarse si el número de Clases, Ordenes,
Familias, ..., presentes en un área, es una estima conveniente y rápida del número de
especies. La pregunta tiene profundas implicaciones prácticas si tenemos en cuenta la
ingente cantidad de trabajo taxonómico descriptivo que aún queda por hacer en extensas
regiones del Planeta, especialmente en las áreas tropicales. En efecto, si esta relación
fuera de carácter universal, podríamos ‘subrogarnos’ a estos taxones
superiores, para obtener estimas prácticas y rápidas de diversidad, sin esperar a
concluir el Inventario exhaustivo de especies. No obstante, los datos no son concluyentes.
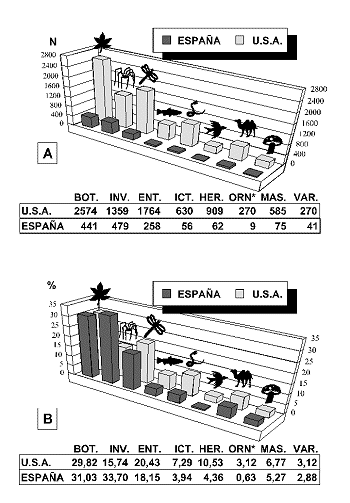
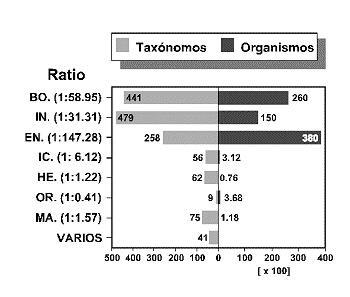
Algunos autores argumentan que sigue siendo necesario dirigir nuestra atención a las especies si pretendemos evaluar y planificar la conservación de la biodiversidad. Así, Prance (1996) constata que de las 292 familias de plantas neotropicales, únicamente 40 son exclusivas o casi exclusivas de esa región. Estas 40 familias reúnen tan sólo 5,777 especies, es decir, el 6.4% de las especies neotropicales conocidas. Por el contrario, sólo dos familias con una radiación explosiva, Bromeliáceas y Cactáceas, reúnen 4,000 especies. Asimismo, analizando la relación especies/géneros en algunas familias pantropicales (Chrysobalanáceas), en los inventarios florísticos de distintos continentes (África y Sudamérica) y los catálogos de algunas regiones tropicales bien inventariadas tales como Perú, Prance termina concluyendo que la riqueza específica es el mejor indicador de la diversidad total de una región
Otros autores, sin embargo, encuentran evidencias de una alta correlación en diferentes regiones, entre el número de familias y el número de especies en diferentes grupos de organismos (Figura 13): helechos, plantas con semillas terrestres y acuáticas, insectos, anfibios, reptiles y mamíferos (Williams & Gaston, 1994; Williams et al., 1994 a, 1997 a). De esta forma, sugieren que la riqueza de taxones de alto rango, puede representar una estima adecuada de la diversidad que, en última instancia, representa la riqueza de especies e incluso más remotamente, la riqueza genotípica (genes) y fenotípica (caracteres).
2.2.2. Medidas de diversidad filogenética
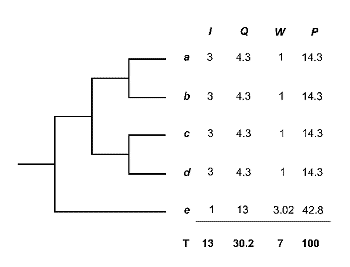
En el transcurso de esta década, sistemáticos y biogeógrafos vienen proponiendo nuevas medidas de diversidad que cuantifican la diferencia o singularidad (‘distinctiveness’) taxonómica de los organismos. Estas medidas se fundamentan en las relaciones genealógicas (ancestro-descendiente) entre organismos, en relación con diferentes modelos de evolución de genes o caracteres (Vane-Wright et al., 1991; Williams et al., 1994 b; Williams & Humphries, 1994; Humphries et al., 1995). El método inicial de Vane-Wright, Humphries & Williams (1991) modifica parcialmente la propuesta de Mickevich y Platnick (1989). Según estos autores, el contenido de información de una clasificación jerárquica está determinado por el número de nodos del cladograma. Es decir, incluso con igual número de taxones, la cantidad de información varía en función de la topología del cladograma.
El procedimiento de estos autores consiste en asignar un valor objetivo a la singularidad taxonómica o grado de independencia en la historia evolutiva de un taxon. El método de Vane-Wright, Humphries and Williams (1991) es simple. El cladograma de la figura 14 lleva asociadas cuatro columnas. La primera (I) indica el contenido de información filogenética de cada taxon (a en 3 grupos; b en otros tres; c: 3; d: 3 y e: 1; Total=13). La segunda columna (Q) contiene los cocientes del total de información (13) entre cada parcial (13:3=4.3; 13:3; 13:3; 13:3 y 13:1=13). En la tercera columna (W) se ha estandarizado dividiendo por el menor valor (4.3). La cuarta columna (P) expresa el porcentaje de Información. Como se puede apreciar, el taxon ‘e’, es el que arroja mayor valor. Así pues, cuanto menor es el número de nodos, es decir el número de cladogénesis y, por tanto, más primitivo es el taxon en una filogenia, mayor es su porcentaje de Información, Peso Táxico o Singularidad Filogenética, ya que la proporción en la que contribuye a la diversidad total del cladograma (contenido de información) es mayor.
Esta medida de singularidad filogenética o Peso Táxico, como la denominaron Vane-Wright, Humphries & Williams (1991), cumple dos condiciones esenciales: i) La equivalencia taxonómica (igual rango) viene expresada por idéntico valor y ii) La singularidad taxonómica varía gradualmente a lo largo del cladograma: no todas las especies son iguales. Sin embargo Williams et al. (1993) han argumentado que, en contra de las expectativas iniciales, la maximización de la divergencia filogenética (primitiva) precoz (‘root weight’), no satisface los valores intuitivos de todos los conservacionistas. Por ello, a lo largo de estos últimos años, han surgido nuevos refinamientos metodológicos que cuantifican la singularidad taxonómica y la diversidad filogenética de los organismos, a través de los rasgos o caracteres - bioquímicos, estructurales, ecológicos, comportamentales,..., - que expresan la variabilidad genética de los organismos y el patrón de divergencia evolutiva representado en los cladogramas. Es decir, los caracteres fenotípicos (y/o los genes que los codifican) proporcionan una ‘divisa’ del valor de diversidad.
Una ventaja de esta aproximación es que proporciona una visión unificada de los tres niveles tradicionales de diversidad, por cuanto utiliza una expresión de la diversidad genética (los caracteres) como base para valorar tanto la diversidad de especies, por su riqueza relativa en genes diferentes, como la diversidad de ecosistemas, por la riqueza relativa de procesos a los que, en último término, contribuyen los propios genes.
En resumen, puesto que los genes y los caracteres que codifican son heredables, los biólogos podemos estimar la biodiversidad mediante medidas taxonómicas o filogenéticas, utilizando nuestro conocimiento de las relaciones genealógicas (jerárquicas) entre organismos en combinación con modelos (anagenéticos, cladogenéticos) de evolución de genes y caracteres (Williams et al., 1994 b; Humphries et al., 1995).
Entre estas medidas vamos a fijarnos esencialmente en dos: la ‘Riqueza de Caracteres’ y la ‘Combinación de Caracteres’ y, más brevemente, en otras dos derivadas de ellas: la Diversidad Filogenética (PD) y la ‘Longitud del subárbol expandido’. Otras más refinadas y también algo más complejas tales como la ‘diversidad p-mediana’ y la ‘diversidad p-mediana discreta’, exceden los límites de este artículo. El lector interesado en profundizar en el tema puede consultar los trabajos de Faith (1992 a y b; 1994 y 1996); Humphries et al., (1995); Williams (1993); Williams & Humphries (1994 y 1996) y Williams et al., (1994 b) y bibliografía en ellos citada.
2.2.2.1. Riqueza de Caracteres
Cuando se trabaja con un gran número de
especies, el valor de la riqueza de especies (![]() -diversidad), tiende a ser una expresión razonable de la
variabilidad genética y de la riqueza de caracteres en que aquélla se expresa. Esta
relación ha sido ilustrada en varios organismos: insectos, plantas neotropicales y aves
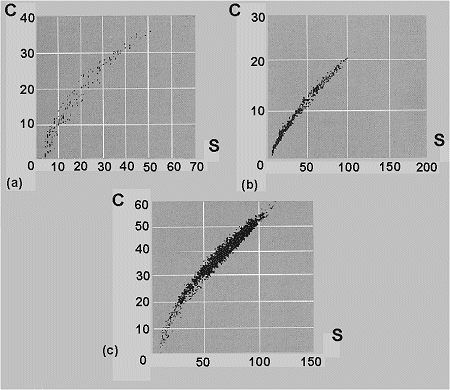
(Williams & Humphries, 1996) (Figura 15).
-diversidad), tiende a ser una expresión razonable de la
variabilidad genética y de la riqueza de caracteres en que aquélla se expresa. Esta
relación ha sido ilustrada en varios organismos: insectos, plantas neotropicales y aves
(Williams & Humphries, 1996) (Figura 15).
|
Figura 15. Algunos ejemplos de relación entre el número de especies (S) y la riqueza de caracteres (C). a: 241 especies mundiales de abejorros del género Bombus (Apidae); coeficiente de correlación de Spearman=0.986; datos de distribución y clasificación de Williams (1991 y 1995). b: 729 especies neotropicales de las familias Dichapeta-láceas, Lecythidáceas, Caryocaráceas, Chrysobalanáceas y el género Panopsis; coeficiente de correlación de Spearman=0.994; datos de Williams/Prance et al. (en prensa). c: 218 especies de aves nidificantes en Gran Bretaña; coeficiente de correlación de Spearman=0.952; datos Gibbons et al., 1993; Williams/Gibbons et al. (en prensa). Modificado de Williams & Humphries (1996). |
Por consiguiente, utilizando clasificaciones, preferiblemente ilustradas como cladogramas, podemos obtener una estimación de la diversidad a través de la riqueza de rasgos-atributos-caracteres que identifican a los organismos. El modelo asume que todos los rasgos se originan y persisten en todos los descendientes del linaje y además, que el patrón de ramificación cladogenética y la longitud de la(s) rama(s) expresada como el número de rasgos que representan novedades evolutivas en un linaje, proporciona una estima adecuada de diversidad (Faith, 1996).
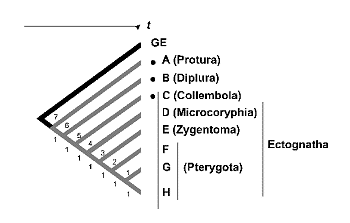
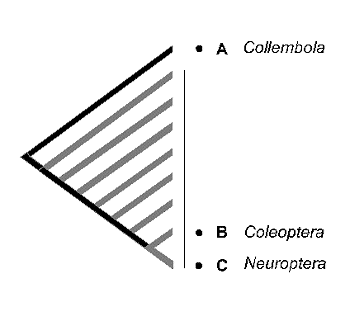
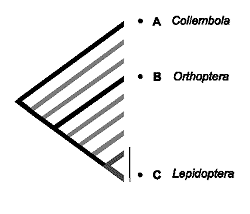
La estimación de la diversidad mediante la riqueza de caracteres responde a un modelo anagenético de evolución, en el que se acepta una relación directa entre la longitud de las ramas que configuran los diferentes linajes y la antigüedad relativa de los taxones. Este es el modelo propuesto comúnmente en la evolución de los atributos moleculares, conocido como ‘reloj molecular’. Si aceptamos esta idea, todos los taxones podrían situarse sobre el árbol filogenético a igual distancia de la raíz, convirtiendo el cladograma en un árbol ultramétrico. Esta equidistancia, se refiere no sólo al eje del tiempo sino también al número de cambios o novedades evolutivas (caracteres) representadas sobre la rama. De la figura 16 se desprende que en árboles ultramétricos, la diversidad medida como la riqueza de caracteres dentro de un conjunto de taxones, es máxima en aquellos taxones de divergencia filogenética precoz o más antigua. Desde esta perspectiva, bastaría conservar A (e.g.: una especie de Proturo), B (e.g.: Dipluro) y C (e.g.: Colémbolo) a pesar de que los taxones D -- H pudieran representar los restantes Ectognatos (D, e.g.: Microcoryphia; E, e.g.: Zygentoma y de F a H e.g.: diferentes grupos de Pterygotas). El mismo sesgo del que adolecía el peso táxico, la medida original de Vane-Wright et al. (1991).
Una aproximación más consistente fundamentada también en la longitud de las ramas que configuran el cladograma, es la formulación original de Diversidad Filogenética (Faith, 1992 a y b, 1994 y 1996). La diversidad filogenética (PD) de un subgrupo de taxones se define como la suma de las longitudes de las ramas que a lo largo del árbol, conectan todos los taxones de un subgrupo de organismos, en dicho árbol, a través del ‘camino más corto’ (‘minimum spannign path’). Desde esta perspectiva, el patrón filogenético para el grupo taxonómico en cuestión, nos da una predicción de los patrones subyacentes de diversidad de rasgos. En efecto, un subgrupo de taxones que evidencian una mayor proporción del árbol, es, en este sentido, más diverso (Figura 17).
Esta definición de la diversidad filogenética origina otro concepto esencial en la cuantificación de la diversidad de los organismos: El concepto de Complementariedad o Incremento de la Diversidad Filogenética, I(x) (Faith, 1992 a; 1994, 1996). La complementariedad en este contexto, se refiere a nuevos rasgos o atributos con los que un grupo adicional de especies puede contribuir a la diversidad del árbol filogenético. Este reemplazamiento (‘turnover’) en rasgos, denominado por algunos autores Q-diversidad (Faith, 1996), juega así el mismo papel que la ß-diversidad en un contexto ecológico.
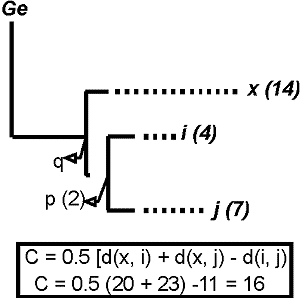
La medida de complementariedad puede ser fácilmente calculada utilizando las distancias entre pares de especies (Faith, 1992 a y 1994). Por ejemplo, para el árbol hipotético de la figura 18 el incremento de la diversidad o complementariedad cuando se añade la especie ‘x’ al subgrupo ‘i’ ‘j’, viene dado para esta sencilla expresión:
C= 0.5 [( d (x, i) + d (x, j) - d (i, j)] C= 0.5 [( d (x, i) + d (x, j) - d (i, j)] (1) (Faith, 1996)
donde d(x, i) y d(x, j) son las distancias entre los pares de especies medidas como número de rasgos a lo largo de las ramas y d(i,j), los rasgos distintos en ‘i’ y ‘j’. En realidad, ‘C’ mide la distancia desde la especie ‘x’ a la porción del árbol representado por el par ‘i’ ‘j’, es decir, la distancia entre ‘x’ y el ancestro ‘p’. Esta distancia representa el incremento en diversidad filogenética, I(x), resultante de la adición de un nuevo taxon:
I (x) = Mínimo sobre todos los i, j
en ‘s’ 0.5 (Dx,i + Dx,j - Di,j) (2) (Faith, 1994).
siendo Dx,i, Dx,j y Di,j,, como acabamos de ver, las distancias entre los pares de especies. Esta fórmula, en realidad, mide la longitud extra del árbol al añadir la rama del taxon ‘x’ al subgrupo ‘s’ de taxones ‘i’ ‘j’.
Si no asumimos una relación directa entre el número de cambios o novedades evolutivas (caracteres, atributos) y el tiempo evolutivo (antigüedad versus modernidad de los taxones), la riqueza de caracteres y, por tanto, la longitud de las ramas, podría no ser una estima adecuada de diversidad. Ahora bien, podemos aceptar que, en cambio, existe una correlación entre el número de cambios y el número de nodos en el cladograma. En tal caso, el patrón de ramificación y por tanto, el valor predictivo de los nodos (especialmente para la diversidad morfológica), podría ser aún más elevado que la longitud de las ramas de los linajes (Williams et al., 1994 b).
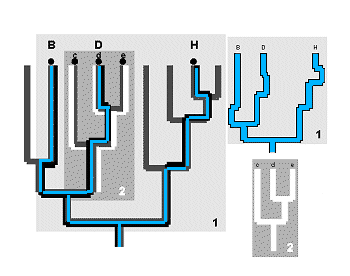
La medida más evidente de representatividad taxonómica, es la longitud del subárbol expandido (‘spanning subtree length’ o ‘cladistic path length’) (Williams et al., 1993). La longitud del subárbol expandido, expresa simplemente la fracción de la clasificación que está representada en el cladograma de un subgrupo de taxones (Williams & Humphries, 1994) (Figura 19) y mide la divergencia taxonómica entre taxones de una biota sumando el número de nodos de la clasificación que median entre todos los nodos incluidos en la biota, contando cada nodo una sola vez. Se trata, por tanto, de un modelo claramente cladogenético.
La longitud del subárbol expandido puede trabajar bien si disponemos de información suficiente sobre la longitud de las ramas del árbol filogenético tal como sostiene Faith (1992 a y 1994), pero sin esta información extra, la versión del conteo de nodos puede ser equívoca y no garantiza completamente la discriminación de los agrupamientos taxonómicos, tal como se le exige a cualquier medida de diversidad (Williams & Humphries, 1994).
2.2.2.2. Combinación de Caracteres
Una medida alternativa a la riqueza de caracteres, consiste en evaluar la riqueza en diferentes combinaciones de caracteres. Esta medida es un refinamiento del criterio de representatividad y descansa sobre el mismo concepto de la longitud del subárbol expandido.
La diversidad medida a través de la combinación de caracteres identifica el subgrupo de organismos distribuidos más regularmente sobre la topología del cladograma. Este patrón de regularidad representará el mayor número de taxones a todos los niveles dentro de la jerarquía taxonómica y, por consiguiente, el mayor número de combinaciones de caracteres (Humphries et al., 1995). El argumento lógico de este criterio es el siguiente: cuanto más regularmente están distribuidos los taxones en el árbol filogenético, el subárbol que los contiene representa mejor la clasificación general (Figura 20) y, por ello, los subárboles más extendidos (‘dispersed’), son más representativos de una variedad de subgrupos con diferentes combinaciones de caracteres.
2.2.3. Medidas Filogenéticas e Información de las Clasificaciones
A menudo se carece de información filogenética y por tanto se desconoce el patrón de divergencia evolutiva de los organismos. En tales casos, la única información disponible sobre las posibles relaciones filogenéticas de los organismos, es la clasificación taxonómica pura y dura. Incluso en tales casos, la clasificación básica puede ser interpretada en un marco de diversidad filogenética (Faith, 1994).
Si el promedio de divergencia taxonómica (es decir, longitud de la rama) con relación al ancestro común de un género es ‘dg’ y el promedio de divergencia de una especie es ‘ds’, el Incremento de Diversidad Filogenética vendrá dado por:
I = G dg + N ds I = G dg + N ds (3) (Faith, 1994)
donde G es el número de géneros previamente no representados y N el número de nuevas especies presentes (Tabla 2).
Williams & Humphies (1994) han criticado esta medida por cuanto la asignación de rangos taxonómicos al margen de las relaciones de grupo hermano, es una labor decididamente arbitraria (ver también Gauthier et al., 1988).
2.3. Medidas Corológicas de Diversidad: Rareza y Endemicidad
Entender el problema de la Biodiversidad, implica discutir el problema de la rareza biológica. En efecto, ya hemos visto que en una muestra finita, son las especies poco abundantes (raras) las que casi siempre quedan fuera del muestreo y, en la mayoría de los casos, la diferencia entre el número de especies observadas y el número real de especies que integran la comunidad, se refiere precisamente a las especies raras.
INFORMACION DISPONIBLE |
VERSION DE DIVERSIDAD FILOGENÉTICA (PD) |
|
| 1 | Clasificación que puede no reflejar la filogenia | I = Gdg + Nds dg, ds subjetivamente definidas; o igual peso para todas las especies. |
| 2 | Información de la Clasificación concordante con la Filogenia | I = Gdg + Nds dg, ds subjetivamente definidas |
| 3 | Información de la Clasificación más información filogenética adicional | I = Gdg + Nds dg, ds variables entre taxones de acuerdo con la información filogenética. |
| 4 | Estimas filogenéticas corroboradas. Únicamente Topologías. | I(x) = 0.5 (Dx,i
+ Dx,j - Di,j) Longitud de las ramas definidas por algún modelo o iguales a alguna constante. |
| 5 | Estimas filogenéticas corroboradas, incluyendo la longitud de las ramas. | I(x) = 0.5 (Dx,i + Dx,j - Di,j) |
Rabinowitz et al. (1986), se dedicaron a estudiar este problema, no tanto desde el punto de vista estadístico de Fisher y Preston, sino enfocando el problema del comportamiento ecológico y caracterización de las especies raras.
La Rareza de un organismo es la condición de ser infrecuente y puede presentarse como rareza de ocupación entre áreas (‘range-size rarity’) o bien como rareza de individuos dentro de un área. Sin embargo, no todas las especies con rangos geográficos relativamente restringidos son localmente poco abundantes y viceversa (Williams et al., 1997 b).
Rabinowitz y colaboradores, encontraron que las causas de la rareza ecológica de las especies dependen, al menos, de la combinación de tres factores: distribución geográfica, especificidad del hábitat y tamaño local de la población. De esta forma, pudieron categorizar hasta siete clases de rareza (Tabla 3). La formulación conceptual de Rabinowitz y colaboradores, tiene enorme trascendencia desde el punto de vista de la Biología de la Conservación como veremos más adelante en el caso de los Insectos. Retengamos por el momento estos tres conceptos:
Rareza Biogeográfica. Se califica así a las especies que colonizan un número reducido de áreas. Aunque a menudo tienden a confundirse, rareza biogeográfica y endemicidad no expresan necesariamente la misma característica espacial. No obstante, como veremos inmediatamente, rareza biogeográfica y endemismo pueden llegar a ser conceptos equivalentes.
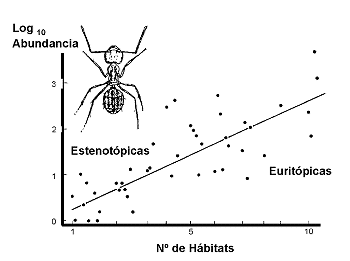
Rareza de Hábitat. Otras especies, en cambio, son muy específicas en cuanto al hábitat, aunque muestran amplios rangos de distribución geográfica. Este grupo está formado por las que se conocen en Ecología como especies estenóicas o de hábitat restringido, en contraste con las eurióicas. La rareza puede estar fuertemente relacionada con la tolerancia al biótopo. Así por ejemplo, Samways (1983) encontró una fuerte correlación positiva entre abundancia y tolerancia al biótopo (Figura 21).
Rareza demográfica. Hay especies que son demográficamente raras, es decir, presentan densidades bajas en todo el área de distribución, aunque ésta sea amplia y aunque no estén asociadas a hábitats muy específicos.
En sentido estricto, la Endemicidad es un concepto diferente al de rareza por cuanto expresa la condición de estar restringido a un área particular, de rango geográfico preestablecido, dentro de un área de estudio. Sin embargo, la rareza de ocupación entre áreas puede ser equivalente a una medida de endemicidad, ya que también el rango geográfico de la(s) especie(s) rara(s), está comprendido dentro del área de estudio y la medida del rango de rareza, es, en definitiva, una expresión relativa a la extensión total de dicho área (Williams et al., 1997 b).
En ocasiones, el calificativo endémico tiene connotaciones biogeográfico-históricas al referirse a elementos relictos cuyo rango geográfico actual, es resultado de procesos de fragmentación y/o reducción del área primitiva en época histórica, más o menos reciente. Pero nuevamente endemicidad y carácter relicto no son conceptos sinónimos, aunque a menudo, pueden ser equivalentes. En efecto, las especies relictas no siempre están constituidas por poblaciones poco abundantes, ni muestran restricciones geográficas o de hábitats.
La endemicidad se define en un contexto geográfico relacional, es decir, en comparación al área de distribución de otros organismos y tiene una amplia aceptación entre los biogeógrafos. En efecto, es un criterio clásico utilizado en el denominado Análisis Crítico de Áreas (Ackery & Vane-Wright, 1988), cuyo objetivo es la selección de áreas de conservación. Este método trata de encontrar el mínimo número de áreas que contienen, al menos, una población de cada una de las especies analizadas, estableciendo la secuencia de áreas de endemicidad: primero las áreas con mayor número de endemismos, en último lugar las que sólo contienen uno; ver también Vane-Wright et al (1991).
La medida de endemicidad expresada como rango de rareza espacial o rango de ocupación de áreas, puede cuantificarse a través del número de parcelas ocupadas en un mapa con una proyección reticulada, por ejemplo, la proyección UTM; por ello, depende fuertemente de la escala espacial utilizada. Así por ejemplo, Baz (1996) expresa la endemicidad como la ocupación proporcional (Pj) de la especie ‘j’ en ‘n’ cuadrículas:
Pj = ![]() Sij/n
Sij/n
donde ‘n’ es el número total de cuadrículas y Sij la presencia/ausencia de la especie ‘j’ en la cuadrícula ‘i’.
Los centros de endemismo, como las áreas que alojan una gran diversidad de especies u otros taxones, o las que incluyen una muestra representativa de la jerarquía taxonómica y/o filogenética, pueden constituir un valor de conservación y se identifican como aquellas áreas en las que coexisten un gran número de especies con distribuciones espaciales muy restringidas (Williams, 1993).
Actualmente se utilizan diferentes medidas del rango de rareza espacial para detectar las ‘Puntos Críticos’ o áreas de máxima endemicidad, comunes a diferentes grupos de organismos. Se usan dos aproximaciones para medir el grado de endemicidad: i) medidas discontinuas, utilizando umbrales espaciales que incluyen únicamente las especies más raras; (e.g.: se considera endémico el cuartil de especies con menor rango geográfico); estos umbrales se establecen arbitrariamente y ii) medidas que son funciones continuas del tamaño del rango geográfico. Estas medidas escapan a la arbitrariedad de los umbrales, pero no existe una fórmula ‘natural’ evidente para pesar la rareza del rango (Williams et al., 1997 b).
Tabla 3
Siete clases de rareza atendiendo a tres características ambientales: Distribución geográfica, hábitat y tamaño de las poblaciones. Modificado de Rabinowitz et al.. (1986). RB: Rareza biogeográfica (endemismo), RD: Rareza demográfica, RH: Rareza de hábitat, U: Especies ubiquistas
| DISTRIBUCIÓN GEOGRÁFICA: | Amplia |
Restringida | |||
| ESPECIFICIDAD DE HÁBITAT | Laxa | Fuerte | Laxa | Fuerte | |
| TAMAÑO DE LAS POBLACIONES LOCALES: | Grande | U | RH | RB | RB; RH |
| Pequeño | RD | --- | RB; RD | RB; RH; RD | |
2.4. Identificando Áreas de Máxima Diversidad
La Conservación es una ciencia de crisis y como tal se espera de ella decisiones, las más de las veces urgentes. Desde este punto de vista es claro que necesitamos conservar y preservar rareza, riqueza, singularidad y los hábitats, ecosistemas y paisajes en los que estas características estén representadas óptimamente. Pero para ello, es preciso aceptar que no todas las especies son ‘iguales’. Más allá de las medidas de diversidad y más allá de los valores humanos imperantes en cada región, precisamos reconocer y cuantificar la singularidad histórico-evolutiva (filogenética) y también, aunque esto es bastante más complejo, la funcionalidad ecológica de las especies.
El propósito de la metodología discutida en las secciones anteriores, es aplicar las medidas propuestas a la conservación in situ de la Biodiversidad, identificando las Áreas Críticas (‘Hot Spots’) con prioridad de acción, de acuerdo con el valor o combinación de valores de diversidad elegidos (Vane-Wright et al., 1991; Faith, 1992 b; May 1990 a). Es más razonable, se argumenta, dar mayor prioridad al área o áreas que alojan una representación óptima de dichos valores: especies de divergencia precoz, número de especies, riqueza de caracteres, combinación de caracteres, endemicidad, etc.
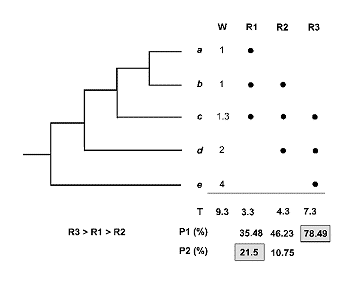
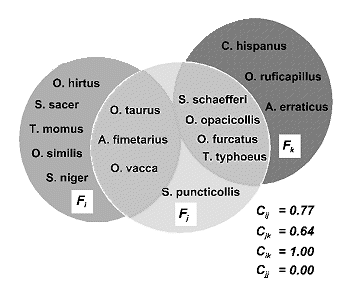
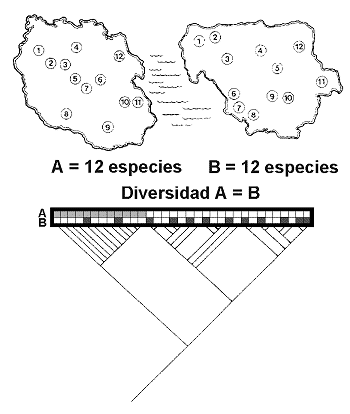
El método inicial de Vane-Wright, Humphries and Williams (1991) identifica los ‘Puntos Críticos’ de diversidad, combinando la información filogenética y biogeográfica en cada área. En la figura 22, R1, R2 y R3 son las regiones en las que están representados los taxones ‘a’, ‘b’,’ c’, ‘d’ y ‘e’. Es claro que si nos basamos en riqueza de especies únicamente, no podremos tomar ninguna decisión. De la misma forma, si tomamos en cuenta el número de endemismos decidiremos que las áreas a conservar son las regiones R1 y R3, ambas con un endemismo; tampoco podremos priorizar ninguna de las dos. Ahora bien, si nos preguntamos cuál es el peso táxico o porcentaje de singularidad taxonómica total en cada región, entonces sí podremos tomar alguna decisión razonada. Veamos cómo:
R1 arroja el 35% del total de información filogenética (T=9.3; 1+1+1.3 = 3.3/9.3=35.48); R2 = 46% (1+1.3+2/9.3) y R3 = 78% (1.3+2+4/9.3); columna P1. Debido a la simpatría de especies los totales suman más del 100%. Así pues, R3 es la primera elección. ¿Cuál es la segunda? De los valores anteriores cabría pensar que la segunda área ha de ser R2 y la tercera R1, ya que R2 aloja mayor porcentaje de información (46,23>35,48). Ahora bien tomando en cuenta el concepto esencial de Complementariedad de faunas, R2 no es la elección correcta. En efecto, si R3 mantiene un estado razonable de conservación de los taxones ‘c’, ‘d’ y ‘e’, estaremos ahora interesados en conservar ‘a’ y ‘b’. Con este argumento volvemos a recalcular los porcentajes de singularidad taxonómica y en la columna P2 anotamos que R1 (1+1/9.3 = 21.5%) en tanto que R2 (1/9.3 = 10.75%). Así pues, el ranking es R3>R1>R2.
Por consiguiente, en la designación de áreas de conservación adquiere especial relevancia el concepto de Complementariedad, el cual, permite distinguir entre áreas irremplazables, flexibles y redundantes. Esto es importante a la hora de establecer criterios de conservación por parte de los gestores del Medio Ambiente.
Como hemos visto al hablar de riqueza de rasgos/caracteres, la complementariedad es una función de los atributos compartidos entre dos o más conjuntos. En sentido estricto, la complementariedad se refiere a la cantidad de nuevos atributos (número de especies, de caracteres, endemismos, etc.) representados en un conjunto, con los que contribuye a otro u otros conjuntos, carentes de dichos atributos.
Si hablamos, por ejemplo, de especies y áreas, la idea se puede expresar gráficamente tal como se ilustra en la figura 23. La complementariedad de las áreas que alojan a las faunas Fi y Fj es mayor que la que existe entre Fj y Fk, es máxima entre Fi y Fk (no comparten ninguna especie) y nula entre dos áreas idénticas. Así pues, el valor de complementariedad siempre será: 0 <= Cjk <= 1.
Colwell & Coddington (1994) expresan la Complementariedad (Cjk) en la ecuación:
Cjk = Ujk/Sjk Cjk = Ujk/Sjk (4)
donde Ujk es el número de especies únicas en ambas listas y Sjk la riqueza total combinada. Ujk y Sjk toman respectivamente los valores:
Ujk = Sj + Sk - 2Vjk
Sjk = Sj + Sk - Vjk
siendo Sj el número de especies en la lista ‘j’; Sk el número de especies en la lista ‘k’ y Vjk el número de especies en común entre ambas listas. En la figura 23, Fi y Fk no comparten ninguna especie y, por tanto, son faunas totalmente complementarias: Sjk = 8 + 7 - 0 = 15 y Ujk = 8 + 7 - 0 = 15; así pues: Cjk= Ujk/Sjk = 15/15=1. Por el contrario, si las dos listas son completamente idénticas (e.g.: Fj y Fj): Sjj = 8 + 8 - 8 = 8 y Ujj = 8 + 8 - 16 = 0; por tanto: Cjj= Ujj/ Sjj = 0/16=0.
Ya hemos visto que la complementariedad
o incremento de la diversidad filogenética para una región determinada se puede calcular
aplicando las expresiones 1 ó 2, dependiendo de la cantidad de
información. En definitiva, todo depende del valor de conservación que estemos
priorizando; si es la ![]() -diversidad
la expresión (4), si es la diversidad filogenética, las fórmulas (1 ó
2).
-diversidad
la expresión (4), si es la diversidad filogenética, las fórmulas (1 ó
2).
3. Las causas de la Biodiversidad
¿Cómo se ha podido producir la diversidad de seres vivos que hoy observamos?, es decir, ¿cuáles son los factores generadores de diversidad a lo largo del proceso evolutivo?. Posiblemente ningún factor por sí solo, es capaz de explicar las causas de diversidad en una región, siendo difícil la agrupación de estos factores en conjuntos razonablemente homogéneos. Tal vez por esta razón, no disponemos aún de una teoría general sobre las causas de la diversidad biológica y no es fácil discernir cuál es la contribución diferencial de cada una de ellas en cada momento y lugar.
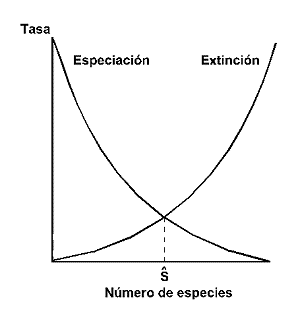
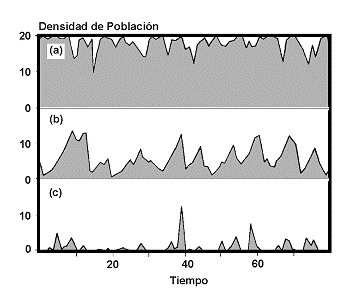
Una de las teorías ecológicas de mayor influencia en las últimas décadas, el paradigma de MacArthur y Wilson (1963, 1967) sobre el equilibrio insular, postula que el número de especies presentes en un lugar determinado, es el resultado de la tasa de generación de especies (o de inmigración en el caso de una isla) y la tasa de extinción (Figura 24).
Una primera división, un tanto académica, que permite una aproximación bastante razonable consiste en considerar los factores intrínsecos, es decir, factores no generados por el medio y sí por las especies que integran la comunidad y los factores extrínsecos, es decir, aquellos que en última instancia, dependen primordialmente del propio medio. Lobo & Martín Piera (1993) han desarrollo en extenso estos argumentos.
Además, la acumulación incesante de datos de diversos organismos que colonizan las distintas áreas del planeta, va permitiendo establecer algunos patrones de variación de la diversidad. Veamos los más importantes.
3.1. Factores intrínsecos
El principio de Exclusión Competitiva establece que es imposible la supervivencia de dos especies en el mismo tiempo y lugar, si éstas comparten idénticos recursos y variables ambientales. Ello viene a significar que no existen dos especies idénticas en sus adaptaciones, como consecuencia de la variabilidad inmensa de las condiciones particulares que han promovido la diferenciación evolutiva de cada una. Aunque esta concepción ha de enfrentarse a la multiplicidad de conceptos de especie y con el desconocimiento de la influencia de las diferencias entre individuos de una misma especie, supone un punto de partida lógico para la comprensión ecológica de la diversidad.
Todos los estudios teóricos y experimentales sugieren que la competencia entre dos especies por el mismo recurso, da lugar a la extinción de una de ellas pero la coexistencia también es posible si el ambiente es heterogéneo, si existe dispersión, si las especies se encuentran agregadas espacialmente, si se considera el papel de los depredadores, o bien, si se produce un desplazamiento de caracteres en alguna dimensión del nicho.
Surge así el concepto de Similitud Limitante: existe un límite en el número de especies que pueden coexistir. De acuerdo con este principio es posible que la diversidad aumente si: 1) existe una mayor gama de recursos; 2) las especies poseen una amplitud de nicho pequeña, es decir, están especializadas en una o varias dimensiones del nicho y 3) la situación contraria, las especies tienen mayor solapamiento de nicho.
Por otro lado, los predadores pueden ser selectivos y atacar a la especie o especies competitivamente superiores, permitiendo la coexistencia. También pueden ejercer este efecto, si depredan sobre las presas más abundantes en cada momento. La predación puede permitir un grado mayor de solapamiento de nicho entre especies competitivas, al disminuir las densidades de población y, por tanto, aumentar la capacidad de carga del medio. No obstante, la predación puede acabar con la presa y, consiguientemente, con el recurso del propio depredador.
La Sucesión es otro factor generador de diversidad. La sucesión es el proceso temporal por el cual se modifica la composición y las relaciones de abundancia entre las especies de una comunidad. Es un proceso típicamente descrito en comunidades vegetales. En este caso las especies pioneras, es decir, las primeras en aparecer, modifican y promueven una mayor heterogeneidad en el medio de modo que crean nuevos recursos para el asentamiento de otras especies, incrementando la diversidad. Durante el proceso de colonización de una isla o del claro de un bosque tras un incendio, las especies van sucediéndose unas a otras a lo largo del tiempo. Cuanto más tiempo ha transcurrido, mayor es el número de especies. Se acostumbra a considerar que los ecosistemas más maduros son más complejos, más diversos. Por ello un territorio con parcelas en diferentes momentos de sucesión, albergará más especies que una área homogénea. Es importante señalar que la Sucesión es también un proceso de sustitución, es decir, no aumenta necesariamente la riqueza por adición de especies.
3.2. Factores extrínsecos
Cuando hay poco alimento disponible, sólo las especies selectivas pueden sobrevivir. Por el contrario, cuando abundan los recursos, encontramos muchas especies exigentes que están especializadas en el consumo de un tipo particular de alimento. De este modo, los ecosistemas que tienen mayor producción de recursos, deberían tener mayor cantidad de especies. Las evidencias, sin embargo, no son concluyentes. Los ecólogos han constatado en numerosas ocasiones que los ambientes muy productivos, tienen pocas especies: las tierras, los lagos o los ríos sometidos a una intensa fertilización, aumentan su producción, pero disminuyen su diversidad. No hay respuesta convincente todavía. En realidad, la relación entre productividad y biodiversidad es confusa. La mayor diversidad parece encontrarse en un umbral medio de productividad (Lobo, 1993).
Como un factor ligado a la productividad, debe considerarse la longitud de las cadenas tróficas. Ya se ha comentado anteriormente que la diversidad de una comunidad puede estar determinada por fuerzas estructuradoras diferenciales como la competencia y predación, según sea la longitud de la cadena trófica y el lugar que ocupe esa comunidad en dicha cadena trófica.
Una zona con muchos tipos diferentes de suelos y superficies, tiene más especies de plantas y un lugar con muchos tipos de árboles alberga más especies de aves e insectos que un monocultivo. Cuantos más hábitats distintos tenga un territorio, más especies diferentes puede albergar. El paisaje tiene muchas parcelas desiguales (parches) y esa heterogeneidad o mosaicismo ambiental, aumenta la diversidad; es la que Whittaker (1970 y 1975) denominó ß-diversidad; ya hemos hablado de ello. Esta podría ser la causa de que haya más especies en un territorio grande que en uno pequeño.
Asimismo, la actividad de cualquier ser vivo crea heterogeneidad. Así, los agujeros de picos picapinos sirven para que aniden otros animales, las hormigas transportan semillas de un lugar a otro y los ciervos, al matar árboles cuando frotan su cornamenta contra la corteza, producen huecos en el bosque (Lobo, 1993).
|
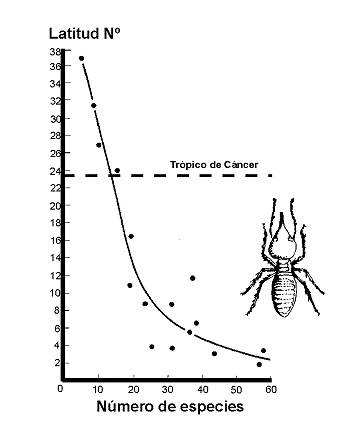
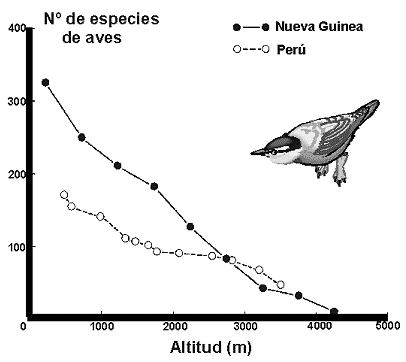
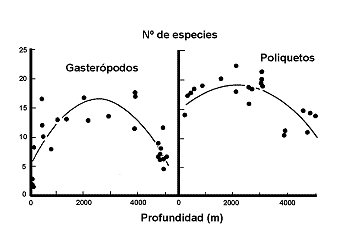
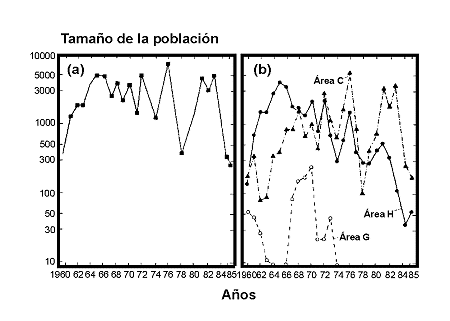
Figura 25. Variación del número de especies de termitas de acuerdo con la latitud al norte del Ecuador. Datos de Sutton & Collins (1991). Modificado de Samways (1994). |
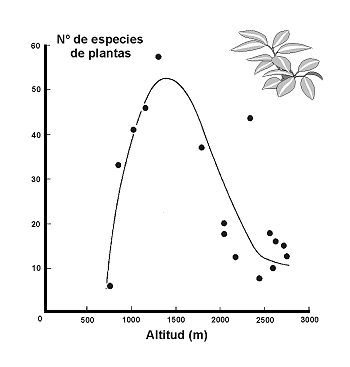
Figura 26. Variación de la riqueza de plantas en montañas del desierto de Arizona (Santa Catalina). Datos de Whittaker & Niering (1975). Modificado de Myers & Giller, (1988). |
Una de las causas principales de que la diversidad sea menor en latitudes altas, es probablemente la inestabilidad climática. En latitudes templadas la acusada estacionalidad promueve la diversidad. La cuestión, sin embargo, no está del todo clara. Los ambientes tropicales son más estables y como es bien sabido alojan una gran diversidad (Figura 25). Lo que sucede es que ni todas las inestabilidades generan diversidad, ni los trópicos son tan estables (Lobo, 1993).
La diversidad se modifica con muchos otros gradientes. Por ejemplo, varía con la altitud y con la profundidad. Las comunidades que viven en las zonas más elevadas de las montañas, están muy aisladas y suelen habitar áreas muy pequeñas. Ello hace que la diversidad disminuya más de lo normal con la altura. Todo parece indicar que el incremento de la diversidad se produce en rangos intermedios (Figura 26). Pero el patrón, nuevamente no es generalizable (Figura 27).
En mar abierto, la diversidad del plancton disminuye rápidamente con la profundidad. Se argumenta que la pérdida de luz es la responsable de este gradiente. Sin embargo, en los años sesenta se descubrió que la diversidad del bentos es máxima a unos 2.000 m. de profundidad y después decae a medida que la luz y el alimento desaparecen (Figura 28); ¿cómo puede ocurrir una cosa así?. Tal vez ello sea debido al hecho de que estos ambientes han permanecido estables durante millones de años, permitiendo así un incremento constante y paulatino de la Biodiversidad, como no ha sucedido en ningún otro lugar del planeta.
En ocasiones la diversidad es producto de la acción combinada de varios de estos gradientes. Así por ejemplo, la estacionalidad, la altitud y la orientación, determinan conjuntamente la diversidad y la abundancia en las comunidades de escarabeidos coprófagos.
En otras ocasiones la diversidad puede no estar relacionada con las características actuales de un área, sino con las del pasado histórico. Se piensa que cuanto mayor es la edad de una comunidad o un ecosistema, mayor es su diversidad (complejidad y estabilidad). Las especies que viven actualmente en el Norte de Europa, colonizaron este territorio tras la retirada de los últimos hielos hace 8.000 años. Durante el último medio millón de años el clima, la fisiografía, la vegetación y la fauna han experimentado cambios casi continuos a tasas muy superiores a las que prevalecieron durante los 200 millones de años precedentes.
En último término, los genes y los taxones representan los productos materiales de la evolución, un proceso irreversible que ha tenido lugar a lo largo de 3.500 millones de años y que ha supuesto millones de eventos de diversificación. Consecuentemente, los organismos representan diferentes combinaciones de sistemas genéticos singulares y compartidos. Mientras que algunas partes del genoma tales como el RNA risobosomal son tan antiguas como la vida misma, a lo largo de la evolución se han ido generando nuevos materiales genéticos. Esta jerarquía histórica de la vida, es la que los sistemáticos intentan reflejar en las Clasificaciones, desde el Reino hasta las especies y las unidades infraespecíficas.
Independientemente de que la jerarquía taxonómica representa sólo una fracción de la diversidad real (estimada entre 5-15 millones de especies; ver a continuación Sección 4.1), la perspectiva histórica de la diversidad es también detectable a escala geográfica, regional y local cuando analizamos las distribuciones geográficas y ecológicas de genes, especies y taxones superiores. Ahora bien, así como las genealogías son difíciles de detectar debido a las homoplasias, los patrones geográficos muy a menudo se complican por procesos estocásticos de dispersiones al azar o introducciones en hábitats no nativos. Sin embargo, podemos coincidir con Léon Croizat en que la vida en la Tierra, muestra diferentes patrones que pueden ser descubiertos a través de análisis biogeográficos. En suma, la diversidad biológica se caracteriza por el reemplazamiento espacial (‘turnover’) a todas las escalas geográficas, por ello, la localización espacial de los componentes de la Biodiversidad, los seres vivos, es una tarea absolutamente crítica si pretendemos un diseño efectivo de una red de conservación in situ (Humphries, Williams & Vane-Wright, 1995).
Finalmente, no cabe duda que el hombre es un una especie que modifica rápidamente el medio, aumentado la inestabilidad de los ecosistemas y extinguiendo especies. Buena parte de los paisajes actuales de nuestro país, no se entienden sin la intervención humana. Por ejemplo, muchos pastizales ibéricos, son el resultado de la actividad ganadera secular y por ello, una interrupción de la trashumancia podría provocar el incremento de los arbustos y del fuego.
El lector interesado puede encontrar una excelente síntesis sobre la explicación de la diversidad en Ricklefs (1995).
4. El Paradigma de la Biodiversidad: Los Insectos
4.1. El problema Taxonómico
Ciertas medidas son consustanciales a nuestro conocimiento del Universo y sin ellas no se explica la imagen que nos hemos formado de él. ¿Cuánto mide el diámetro de la Tierra?: 12.742 km.; ¿cuántas estrellas hay en la Vía Láctea?: aproximadamente 1011; ¿cuántos genes hay en un virus?: 10 en el fago X174; ¿cuál es la masa de un electrón?: 9.1 x 10-28 gr; ¿cuántas especies de organismos habitan la Tierra?, no lo sabemos, ni siquiera el orden de magnitud (May, 1986, 1988, 1989, 1990 b, 1992; Hammond, 1995).
La cifra de Insectos se ha situado en torno a las 750.000 especies. Algunas estimaciones más recientes elevan esta cifra a 1.112.000 (Samways, 1994) y, sin embargo, muchos entomólogos hasta hace muy poco tiempo, habrían estimado que el número de insectos no superaría el millón y medio de especies. Williams (1964) dobló esta estimación a 3 millones de especies. Con estos datos Quintin Wheeler (1990) y el dibujante Francis Fawcett, han recreado un paisaje imaginario en el que cada grupo de organismos refleja las actuales estimas de diversidad (Figura 29). Sin embargo, Erwin (1982, 1983 a y b, 1988 y 1985) sugirió que en los bosques tropicales esta cifra se sitúa en un punto entre los 30 y los 50 millones de especies.
El tamaño de los organismos representa el número de especies en cada Taxon.
|
 |
Número de especies descritas: |
|||
| TAXON | ESPECIES |
TAXON | ESPECIES |
| 1 Monera | 4,760 | 11 Mollusca | 50,000 |
| 2 Fungi | 46,983 | 12 Echinodermata | 6,100 |
| 3 Algae | 26,900 | 13 Insecta | 751,000 |
| 4 Plantas | 248,428 | 14 Artrópodos no insectos | 123,161 |
| 5 Protozoos | 30,800 | ||
| 6 Porifera | 5,000 | 15 Pisces | 19,056 |
| 7 Coelenterata | 9,000 | 16 Amphibia | 4,184 |
| 8 Platyehelminthes | 12,200 | 17 Reptilia | 6,300 |
| 9 Nematoda | 12,000 | 19 Mammalia | 4,000 |
| Fuentes estadísticas: E. O. Wilson, Ed., 1988, Biodiversity, Nat. Acad. Sci. Press, Washington. | |||
| Figura 29. Paisaje imaginario creado por Wheeler (1980) y F. Fawcett, en el que el tamaño de los organismos es proporcional a la diversidad taxonómica de la Clase a que pertenece. Incluso con las estimaciones más moderadas, el tamaño proporcional de los insectos, representado en el gráfico por un coleóptero, aún debería ser mayor. Modificado de Wheeler (1980). | |||
Esta estimación causó tal impacto que en los últimos cinco años ha sido uno de los temas más recurrentes en la literatura entomológica. No faltan autores que consideran las estimaciones de Erwin ciertamente exageradas. Así, Gaston (1991) argumenta que 10 millones de especies, es una estima mucho más razonable de acuerdo con el conocimiento y experiencia de los diferentes especialistas que trabajan en todo el mundo. Erwin (1981) rebate los argumentos de Gaston, arguyendo que las estimas de los especialistas, no son un criterio científico sino un criterio de autoridad. La polémica aún no ha terminado.
Es difícil sondear las implicaciones de estos números. Las cifras se disparan cuando las estimaciones se hacen en términos de individuos o biomasa (Wilson, 1991). Así por ejemplo, tomando esta última medida, se ha estimado que la biomasa de hormigas en los trópicos, empequeñece la biomasa total de mamíferos.
En todo caso, basándonos solamente en las especies descritas hasta la fecha, dos de cada cinco organismos vivos son un insecto. Ahora bien, si el número de especies estimadas alcanza solamente los 10 millones de especies, es muy probable que esta proporción se incremente a 4 de cada 5 pero, probablemente, menos del 10 por ciento de los insectos han sido descritos formalmente con un nombre científico (Samways, 1993). Esto implica que cuando hablamos de extinción de especies y pérdida de Biodiversidad, estamos refiriéndonos casi por completo a unos pocos megataxones: Insectos y otros invertebrados tales como, Ácaros, Anélidos y Hongos, a pesar de su escasa presencia en las denominadas Listas Rojas (véase más adelante Sección 4.3).
Es difícil documentar con precisión la extinción cuando muchas especies, particularmente de insectos, aún no han sido descritas. Por otro lado, las tasas de extinción varían entre áreas geográficas y tampoco son idénticas en todos los organismos (May et al., 1995). Las actuales estimaciones arrojan cifras verdaderamente alarmantes: Entre el 10 y el 25% de los seres vivos, podrían extinguirse en los próximos 25-30 años (Raven, 1988); ¿a qué velocidad?. Con una estimación tan moderada como 5 millones de seres vivos confinados en las áreas tropicales, Wilson (1988) popularizó la cifra de 17,500 especies como la tasa anual de extinción en los bosques tropicales.
Hace ya una década la FAO estimó que la destrucción anual del bosque lluvioso tropical es de 70,000 km2 anuales; un área casi equivalente a toda Andalucía, es decir, 40.5 Ha./3 minutos. Estimaciones más recientes sitúan la tasa de deforestación en el rango de 0.8-2% anual (Reid, 1992; Groom & Schumaker, 1993). Aplicando la relación especies-área a la misma estimación de 5 millones de especies, May et al. (1995) obtienen una extinción anual de 10,000-25,000 especies, o sea, 24-72 especies/día, 1-3 especies/hora.
¿Qué significado tienen estas cifras en términos evolutivos?. Si no somos capaces de invertir la tendencia actual, la tasa actual de extinción podría ser 400 veces superior a la del pasado geológico reciente. Los paleontólogos estiman que la tasa promedio de extinción de especies es del 9%/millón años, es decir, 0.000009 spp/año. Si aceptamos que la Biosfera reuniera una modestísima cifra de 2,000,000 especies, la tasa natural de extinción equivale a 0,18 spp/año (2.000.000 x 0.000009%); en cinco años: 0.18 x 5 años= 0,9 spp /5 años (. 1~5 años). Asumiendo como indican algunos paleontólogos, que la estimación es 10 veces superior (Raup, 1988), tendremos 10 spp/5 años, o bien 2 spp/año. Ahora bien, si el catálogo de la Biosfera ascendiera a 50,000,000 especies, como sugirió Erwin (1982, 1983 a y b 1985), el factor de proporcionalidad respecto al catálogo conocido es de 25, por tanto el factor de extinción natural debería ser igualmente de 25. En consecuencia la tasa natural de extinción anual debería ser 25 x 2 = 50 spp/año. Como la estima de extinción en valor absoluto es de 17,500-20,000 spp/año, resulta que la tasa real de extinción es 400 veces superior (50 x 400 = 20,000). El lector puede entretenerse en hacer el mismo ejercicio a partir de la cifra más moderada de 10,000,000 de especies en toda la Biosfera. Encontrará, en este caso, que el incremento de la tasa de destrucción (si sigue siendo cierto que desaparecen 20,000 spp/año) es 2,000 veces superior a lo que predicen los paleontólogos; cifra que se sitúa en el rango de 1,000-10,000 estimado por Wilson (1988).
Así las cosas nos enfrentamos a una paradoja y un dilema. La paradoja es que a medida que vamos incrementando nuestra capacidad de trabajo (descripciones taxonómicas asistidas por ordenador, gestión informática de enormes Bases de Datos faunísticos, esclarecimiento de patrones filogenéticos y biogeográficos, análisis de procesos ecológicos, etc.), las especies están desapareciendo incluso antes de que podamos llegar a conocerlas. Es fácil imaginar el dilema: ¿qué hacer?, ¿cuán rápido?. Intentaré contestar a esta cuestión como entomólogo profesional valorando el trabajo realizado, la tarea pendiente y los recursos humanos disponibles.
Estos dilemas están exacerbados por un complejo entramado de factores sociales, políticos y económicos alguno de los cuales, como la deforestación, los acabo de mencionar. Otros en cambio, entran en el terreno de lo que solemos denominar políticas científicas o sociología de la ciencia, e incluso, en el juego de poder de los ‘lobbies’ científicos; e.g.: Genoma Humano versus Inventario de la Biodiversidad.
|
Figura 30. Modelos de fluctuación en poblaciones hipotéticas. a: poblaciones fluctuantes próximas a la máxima capacidad de carga del medio (K=20). Bajo este supuesto, las poblaciones están afectadas por fluctuaciones ambientales dentro de un rango predominantemente favorable de condiciones microambientales. Este podría ser el caso de una población de insectos en un bosque tropical. b: La población fluctúa en un amplio rango de densidades, entre K y L (límite inferior), con extinciones locales ocasionales y reinvasiones. En este caso, la población está afectada por cambios ambientales que originan incrementos y descensos demográficos en la parte ‘intermedia’ del rango de condiciones microambientales. c: La población fluctúa cerca del límite demográfico inferior (L=0) y la mayor parte del tiempo es ‘rara’, aunque está sujeta a explosiones ocasionales. En este caso, la población existe a bajas densidades y está afectada por fluctuaciones que actúan sobre los individuos en el rango más favorable del gradiente microambiental. Datos de Whittaker (1975). Modificado de Samways (1994). |
4.2. Las poblaciones de Insectos. La rareza de los Insectos
Las poblaciones de insectos difieren considerablemente en la constancia de sus niveles demográficos y sus comunidades son muy dinámicas. Algunos son relativamente constantes de generación en generación, otros en cambio, varían frecuentemente y otros, en fin, se mantienen a niveles constantemente bajos y solo ocasionalmente son abundantes (Figura 30). La supervivencia de las poblaciones de insectos implica por tanto factores espaciales y temporales. Algunos estudios autoecológicos sobre mariposas, han mostrado que incluso especies muy localizadas y fuertemente amenazadas experimentan grandes variaciones de población (Figura 31). Incluso cuando la población es dividida en subunidades demográficas, se puede constatar que algunas de estas subunidades pueden llegar a extinguirse, reaparecer y volver a extinguirse. Todos estos estudios demuestran que no es posible un buen conocimiento de las poblaciones de insectos sin una amplia perspectiva temporal. Ciertos rasgos del medio pueden parecer triviales en un año de observación, al año siguiente igualmente banales con densidades muy diferentes y al siguiente mostrarse decisivos.
Por otro lado, Gaston & Lawton (1990) han señalado que en insectos lo más frecuente es una estrecha relación entre abundancia local y rango geográfico. Es decir, una especie localmente abundante, generalmente tiene un amplio rango geográfico. No faltan sin embargo ejemplos en que no es posible establecer relación entre abundancia y rango geográfico.
Dos preguntas surgen inmediatamente, si las poblaciones de insectos fluctúan en el espacio y en el tiempo tan ampliamente, ¿cómo adscribirlas a una categoría de rareza demográfica, geográfica o de hábitat? y ¿qué extensión debe tener el área geográfica para tener una cierta garantía de éxito en la conservación?. Difíciles cuestiones que nos reafirman nuevamente en la idea de que la conservación de los insectos es una ficción sin un conocimiento bien fundamentado en estudios de fuerte dimensión temporal y espacial. Pero este tipo de estudios básicos suponen un esfuerzo de inversión en recursos humanos y materiales que los gestores de la política científica y del Medio Ambiente, no siempre o casi nunca, están dispuestos a financiar.
La rareza no sólo está relacionada con la abundancia y el rango geográfico sino también con la tolerancia al biótopo, es decir con su rango de euritopia o estenotopia; ya lo hemos visto (Figura 21).
Para acabar de complicar aún más las cosas la rareza en insectos tiene otras manifestaciones, no sólo la demográfica, también un fuerte polimorfismo cromosómico, enzimático, ontogenético y sexual así como una gran variedad de ciclos biológicos alternativos y numerosas manifestaciones de mimetismo batesiano y mülleriano (Samways, 1993). Todas estas manifestaciones de variabilidad requieren una diversidad de estrategias de conservación. Así por ejemplo, los diferentes estilos de ciclo biológico en insectos, son una variable importante a considerar desde el punto de vista de su preservación. No podemos olvidar que muy a menudo, los distintos estados ontogenéticos (especialmente en insectos holometábolos), se comportan como individuos muy diferentes desde el punto de vista ecológico, fisiológico, etológico y demográfico. Conservar una especie de insecto holometábolo puede implicar la preservación de hábitats muy diferentes dado que el adulto y las fases larvarias pueden vivir en medios diferentes, alimentarse de recursos igualmente diferentes y pueden sufrir presiones competitivas distintas. Por ejemplo los Escarabeidos adultos del género Cetonia son florícolas y palinófagos sobre Fagáceas, Cistáceas, Compuestas, Gramíneas, etc.; las larvas, en cambio, viven a expensas de materia orgánica en descomposición. Los Odonatos adultos son voladores y activos depredadores en el medio aéreo; las larvas, sin embargo, son acuáticas. Los escarabeidos coprófagos adultos son de vida libre, compiten por el recurso trófico y por el espacio para la nidificación y pueden sufrir la depredación; las larvas son endogeas, viven confinadas en habitáculos-despensas o bolas-nido que les garantizan el alimento, la depredación es menor pero se conocen casos de cleptoparasitismo.
4.3. La Conservación de Insectos: Dilemas, Ficciones y ¿Soluciones?
Llegados a este punto cabría preguntarse ¿por qué hay que conservar Insectos?. Hay varias áreas de interrelación Hombre-Insecto, pero la importancia de esta interrelación no ha sido aún completamente establecida.
Aunque únicamente 200 especies de insectos son realmente plagas serias, su impacto es enorme. En realidad podemos responsabilizarlas de la pérdida de, al menos, el 30% de todas las cosechas mundiales. Actualmente se estima que el número de plagas potenciales ronda los 10.000 especies de insectos. Incluso así, esto es sólo el 1% de las especies descritas. No menos agresivos parecen desde el punto de vista médico y veterinario como vectores de graves enfermedades, algunas incluso mortales: malaria, dengue, leishmaniosis, enfermedad de Chagas, enfermedad del sueño y un largo etc. No hay muchos motivos para la condescendencia.
Además de la precaución con este minúsculo número de plagas, hay, en general, una gran dificultad para percibir la importancia de los Insectos en los procesos y dinámica de los ecosistemas. Sin embargo, cualquier plan global de conservación debe tener en cuenta las necesidades de supervivencia en términos de funcionamiento ecológico, del conjunto de la biota terrestre (incluida nuestra propia especie) y los Insectos, son el componente cuantitativamente más importante de los ecosistemas terrestres, aunque la funcionalidad de la mayoría de las especies, nos es aún completamente desconocida.
Así pues, si el Hombre está dañando la estructura y funcionamiento de la diversidad en la Biosfera y los Insectos son el componente mayoritario de esta Biodiversidad, estamos dañando, primordialmente, la diversidad de Insectos, antes incluso de que lleguemos a conocer cuáles son sus ‘servicios ecológicos’. Esto no es chovinismo entomológico.
Con la excepción de unos pocos productos tales como la miel y algunos tintes, los Insectos poco tienen que ofrecer. Su pequeño tamaño, su esqueleto quitinoso y la gran variabilidad de sus poblaciones, les hace poco atractivos. Son sus ‘servicios’ ecológicos, su papel en la mayor parte de los ecosistemas terrestres como predadores, parasitoides, recicladores de nutrientes y materia orgánica, polinizadores, etc. (Samways, 1993), la razón por la que deben ser conservados. Los hábitats y paisajes en los que ellos viven deben ser también preservados y, en todo caso, utilizados de manera sustentable y duradera. Así pues, los Insectos deben ser conservados per se, no por su valor económico que aún está por establecer (Samways, 1993 y 1994).
Tendemos a considerar que la conservación de especies se relaciona prima facies con las especies raras. Ya hemos visto las dificultades para aplicar este calificativo a los Insectos. Cambian de categoría incluso más rápidamente que las plantas, debido a su variabilidad poblacional, particularmente en respuesta a los cambios del medio. Los Insectos además migran en respuesta a las modificaciones del paisaje, o en respuesta a cualquier modificación biótica (patógenos) o abiótica (clima). Las categorías de Rabinowtiz et al. (1986) son un marco conceptual muy útil en la conservación de los Insectos. Sin embargo, la naturaleza dinámica de sus poblaciones, a corto plazo bajo la influencia de los paisajes antropizados y a largo plazo bajo la influencia de cambios geológicos o climáticos, convierte a menudo en un artificio vacío de contenido biológico, la adscripción de las especies de insectos a las categorías de rareza.
Todo esto sin tener en cuenta el componente sociopolítico y hasta psicológico de la rareza. Una especie puede ser considerada rara en un país y es completamente común en otro.
El conocimiento de la distribución geográfica de los insectos es esencial para tomar decisiones sobre su conservación y preservación. La escala espacial tiene un importante impacto en la percepción de la rareza, amenaza y estabilidad de las poblaciones. Los mapas de distribución generalizada como los que estamos acostumbrados a ver en las guías de vertebrados, son de valor muy limitado en insectos con su pequeño tamaño y restricciones de hábitat y biótopo. Muchos de estos mapas son más potenciales que reales y, en el caso de los Insectos, a menudo reflejan la distribución de los entomólogos y no la del insecto en particular. En términos de urgencia el cartografiado de especies, paisajes, ecosistemas y tipos de biótopos (Clark & Samways, 1992) y la predicción de las áreas potenciales de distribución (Bartlein et al., 1986; Buckland & Elston, 1993; Scott et al., 1993; Huntley et al., 1995) mediante modelos de regresión (presencia/ausencia de especies en parcelas de territorio y las variables ambientales) (Smith, 1994) y/o la utilización de Sistemas de Información Geográfica (SIG) (Jones et al., 1997; Skov & Borchsenius, 1997), son algunos de los objetivos más inmediatos y realistas. Los SIG son una herramienta extremadamente valiosa para llevar a cabo esta tarea, eso sí, siempre y cuando seamos capaces de completar nuestras bases de datos biológicos. En nuestro país, sin embargo, aún no se dispone de un banco nacional de datos zoológicos, aunque muchos investigadores poseemos nuestras pequeñas bases de datos de trabajo.
Con todos estos datos en la cabeza, ¿qué significado biológico tienen los Libros Rojos y las Listas Rojas de Insectos?; muy poco. A pesar de su buena voluntad, frecuentemente, tales libros y listas son arbitrarias, subjetivas y están fuertemente sesgadas desde un punto de vista antropocéntrico hacia ciertos grupos ‘más bonitos’, ‘más grandes’ o ‘más comúnmente conocidos’ tales como las mariposas o las libélulas.
La idea de que los Insectos merecen ser conservados no es nueva, pero es una idea que el hombre encuentra difícil aceptar. Estamos condicionados a creer que los Insectos deberían ser arrasados indiscriminadamente. Se interrelacionan muchas causas en esta percepción. Unas son de índole científica; ya las hemos comentado brevemente, otras son de índole psico-sociológica. El gran público los repudia o más a menudo los ignora, son molestos, dañinos o incluso vectores de enfermedades, a veces, mortales. En el fondo son nuestros más directos competidores. Mantenemos una relación esquizótica con ellos que va desde su mitificación como criaturas sagradas (véase Martín Piera o Grustán, en este mismo volumen) y la seducción por la belleza de sus formas y colorido, hasta el más mortal de los odios: los insecticidas. Incluso desde un punto de vista estrictamente conservacionista, el tamaño de los insectos es un elemento antropocéntrico que sesga los criterios de conservación a favor de otros organismos y también dentro del propio mundo de los Insectos; los más grandes y los más bonitos. ¿A quién se le ocurre conservar, por ejemplo, un pequeño curculiónido de 5 mm?, solamente a quien comprenda cuál es su ‘servicio’ ecológico. Lamentablemente, sabemos muy poco de la funcionalidad ecológica de la mayoría de los insectos; ya lo hemos comentado.
Desde que en 1835 Parnassius apollo fue declarada como especie protegida, unos pocos insectos han ido apareciendo tímidamente en la legislación de algunos países. Citaré sólo algunas: En Inglaterra el Comité para la Protección de Insectos de la Real Sociedad Entomológica se remonta a 1925, en Francia la Oficina para la información eco-entomológica y en U.S.A. la Xerces Society fundada en 1971 (Samways, 1994). En los Convenios internacionales, sólo algunos insectos aparecen recogidos en la Lista Roja de Animales amenazados de la IUCN (1990) y en los convenios de Berna (1971), Bonn (1979) y CITES (1973). Existen además algunas declaraciones de principios sobre el valor y ética de la conservación de invertebrados, tales como la Carta de los Invertebrados Europeos adoptada por el Consejo de Ministros de la CEE en 1990 y en nuestro país, el Manifiesto de Calpe sobre la gestión medioambiental y la conservación de Artrópodos (Jiménez-Peydró & Marcos-García, 1994; ver también Galante, 1994 y Nieto-Nafría, 1994).
A pesar de este cúmulo de buenas intenciones ¿cuál es la realidad?. El Anexo IV de la Directiva Comunitaria 92/43 (1992), referido a las especies animales y vegetales que necesitan protección en el ámbito de la CEE, recoge un total de 47 especies de Artrópodos: 8 Coleópteros, 23 Lepidópteros, 12 Odonatos, 1 Mántido, 2 Ortópteros y un Arácnido (ver también Rosas et al., 1992). La misma Directiva recoge más de 160 especies de vertebrados. Con estos datos resulta evidente que los criterios de conservación son de carácter claramente antropocéntrico. Si tenemos en cuenta que el número de especies que colonizan solamente la Península Ibérica asciende a 38.000, no parece exagerado afirmar que, hoy por hoy, la conservación de insectos es una auténtica ficción. ¿Quiere esto decir que no es posible?, en modo alguno, sólo quiero decir que, simplemente, no se lleva a cabo.
Todo lo dicho hasta aquí arroja serias dudas sobre voluntad de conservación de los Insectos y también y aún más importante, sobre la validez de la aplicación de los actuales criterios conservacionistas a estos organismos. Tal vez, ambos factores (falta de voluntad y de criterio), se interrelacionan mutuamente y son recíprocamente sinérgicos. Es cierto que hace falta voluntad pero no es menos cierto y es aún más urgente, adoptar nuevos criterios que tomen en cuenta los peculiares desarrollos y biología de los Insectos, sus grandes fluctuaciones demográficas, sus cortos tiempos de generación, sus adaptaciones a diferentes biótopos. Todo sugiere que los Insectos se ajustan a dinámicas metapoblaciones con diferentes tasas de colonización entre subpoblaciones; distribuciones desiguales y fluctuaciones temporales también desiguales, entre las subpoblaciones que colonizan diferentes biótopos.
Teniendo en mente el gran impedimento taxonómico y siendo el tiempo tan corto, hay una auténtica necesidad de identificar áreas de máxima diversidad de insectos (‘Hot Spots’) y centros de endemicidad y/o rareza. Estas áreas críticas, son la ‘casa’ de especies taxonómica y/o ecológicamente importantes y, tal vez, los centros de diversificación actual y futura de las especies de insectos. Por estas razones Samways (1994) ha sugerido que hasta que no dispongamos de un Inventario razonablemente completo de estos organismos, deberíamos utilizar el término ‘comunidad amenazada’ en lugar de ‘especie amenazada’. Incluso en términos de organismos terrestres, Samways sugiere que aún sería más adecuado el término de ‘paisaje amenazado’, incluyendo paisajes antropizados y más o menos intactos.
4.4. Inventarios y Clasificaciones
Retomemos las dos preguntas iniciales: ¿qué hacer? ¿cuán rápido?. Cuatro frentes de ataque podrían aportar alguna solución: i) acelerar el Inventario de la Diversidad Orgánica así como nuestro conocimiento filogenético; ii) estimar la diversidad a través de grupos clave (indicadores) taxonómicamente bien conocidos, en los diferentes ambientes, paisajes y ecosistemas, aplicando criterios ecológicos y sistemáticos (Sección 2.1 y 2.2), a fin de establecer los puntos críticos o áreas de máxima diversidad; iii) investigar los procesos ecológicos relativos a la funcionalidad de los Insectos en los ecosistemas terrestres (Sección 2.2.) y iv) a tenor de nuestro desconocimiento general de la diversidad orgánica, su magnitud y sus causas, conservar y preservar más de lo estimado, incluso a ciegas. Del segundo, tercer y cuarto puntos ya he hablado, me referiré ahora al primero.
¿Qué es un Inventario de especies?. Aquí surgen las primeras discrepancias no tanto sobre el qué es sino cómo realizarlo; con qué criterios. En su mínima expresión, Janzen (1993) define un Inventario como una‘... base de datos taxonómicamente limpia que indica, al menos, un punto geográfico donde se encuentra una especie...’. A esta visión un poco simplista, Wheeler (1995) opone una concepción que separa lo que es el inventario propiamente dicho de la localización geográfica. Wheeler define el Inventario del mundo orgánico como un Inventario Taxonómico, esto es ‘... la exploración, análisis filogenético y clasificación predictiva de todas las especies de un taxon en todo el mundo...’ (Figura 32). Así pues, una visión eminentemente pragmática (Janzen) frente a una concepción rigurosamente científica (Wheeler); ambas sustentadas en el trabajo taxonómico.
Llegados a este punto cabe preguntarse cuál es el estatus de la actual sistemática de Insectos. Existe la opinión generalizada de que la Sistemática biológica es una actividad en franco declive. Veamos un par de ejemplos extremos: U.S.A y nuestro propio país.
La figura 33 muestra las diferencias en valor absoluto y relativo entre ambas comunidades de sistemáticos. Aunque las diferencias en valor absoluto son abismales, la tendencia de la distribución por especialidades es, en términos porcentuales, comparable. En Estados Unidos los entomólogos son cuantitativamente el segundo colectivo, tras los botánicos, en tanto que en nuestro país, ocupamos la tercera posición tras los invertebratólogos. Estas cifras son más fácilmente valorables con relación al número de organismos del que se ocupa cada colectivo de taxónomos. Wheeler (1990) ha calculado la ratio taxónomos/especies con los datos de la comunidad taxonómica de EE.UU. y la diversidad mundial actualmente conocida. Obtiene unas cifras que para el caso de los entomólogos sitúan esa ratio en 1:432. Con la estimación de 10 millones esa ratio debería ascender a r=1:5,669 y con las estimas de Terry Erwin (1982, 1983 a y b y 1985) alcanzaría r=1:28,345. Como tarea no está nada mal.
|
Figura 34. Ratio Taxónomos/Organismos en la comunidad de sistemáticos españoles. Bo.: Botánicos. In.: Invertebratólogos. En.: Entomólogos. Ic.: Ictiólogos. He.: Herpetólogos (anfibios y reptiles). Or.: Ornitólogos. Ma.: Maztozoólogos. Varios: Restantes phyla. Fuentes: ‘DIRTAX’ (García-Valdecasas et al., 1994), Blanco & González (1992), datos inéditos del Proyecto Fauna Ibérica (Ramos, 1995) y estimación de organismos vegetales a partir del Proyecto Flora Ibérica (Castroviejo, 1995). Las cifras de organismos están expresadas en centenares (x 100). |
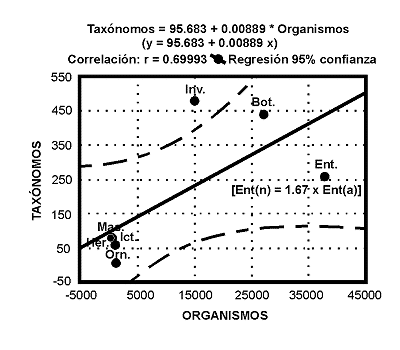 Figura 35. Regresión entre el número de biosistemáticos españoles, por especialidades, y magnitud taxonómica de cada grupo en el área íbero-balear. Bot.: Botánicos, Inv.: Invertebratólogos. Ent.: Entomólogos, Ent(n): Entomólogos necesarios de acuerdo a la diversidad taxonómica española, Ent(a): Entomólogos actualmente en activo. Ict.: Ictiólogos. Her.: Herpetólogos (anfibios y reptiles). Orn.: Ornitólogos. Mas.: Maztozoólogos. Fuentes: ‘DIRTAX’ (García-Valdecasas et al., 1994), Blanco & González (1992), datos inéditos del Proyecto Fauna Ibérica (Ramos, 1995) y estimación de organismos vegetales a partir del Proyecto Flora Ibérica (Castroviejo, 1995). |
¿Cuál es la situación española?. En nuestro país con una estimación de 38.000 spp. de insectos la ratio es 1:147.28. En relación con las cifras de Wheeler la tarea se divide por 3 pero los taxónomos se dividen por 7 (Figura 34). Es decir, el colectivo de entomólogos que en nuestro país se dedican a la taxonomía de entomofauna ibérica (la séptima parte de los que trabajan en USA), debe realizar un esfuerzo solamente tres veces inferior al ue deberían realizar todos los taxónomos USA, dedicados a describir 750,000 especies de insectos. Como tarea tampoco está nada mal. En este sentido, resulta ilustrativo, la regresión entre ambos valores, taxónomos y especies. La figura 35 indica claramente que en el momento actual, el colectivo de entomólogos (258) resulta claramente insuficiente, estimándose que debería incrementarse en un factor de 1.67 hasta alcanzar un nivel similar al de otras especialidades en nuestro país, es decir, aproximadamente 430 especialistas.
Una de las propuestas más audaces para finalizar en un plazo razonable de tiempo el inventario de la diversidad, fue la que lanzaron los comités editoriales de las tres revistas sistemáticas más prestigiosas: ‘Cladistics’, ‘Systematic Botany’ y ‘Systematic Biology’. Esta iniciativa se conoce como ‘Systematic Agenda 2.000' (SA-200) (Blackmore & Cutter, 1996). Ahora bien, suponiendo que toda la Biota terrestre incluyera no más de 5 millones de especies, al ritmo actual de descripción (» 8,335 spp/año), tardaríamos 6 siglos (600 años) en concluir el Inventario de la Diversidad Orgánica. Por consiguiente, la única posibilidad de acabar dicho Inventario en 25 años, como proponen los promotores de la SA-2.000, sería multiplicar por 24 la tasa de descripción actual, pasando de las 8,335 ssp/año a las 200,000 spp/año (recordemos que el promedio anual de extinción de especies era de 167,000 spp/año). ¿Cómo se hace esto? ¿multiplicando por 24 el número de taxónomos mundiales o exigiéndoles 24 veces más trabajo?. Yo no he encontrado nada en la interesante SA- 2.000 sobre esta cuestión. Antes al contrario, hoy sabemos que la tendencia general es más bien la inversa, esto es, el abandono de la Sistemática biológica.
Si no parece posible o al menos es altamente improbable que seamos capaces de acelerar el Inventario de la Diversidad Orgánica, parece que la única opción razonable es Conservar, es decir, mantener lo que tenemos con un uso ponderado o como ahora se dice, sustentable y en otros casos Preservar, o sea, mantener intactos algunos legados evolutivos singularmente valiosos (Samways, 1994).
1. Actualmente tenemos pocas estimaciones de la Biodiversidad y sabemos muy poco acerca de sus causas. Las fuerzas que los ecólogos han propuesto, actúan a menudo en sentidos contrarios y es muy difícil emitir una opinión basada en hechos bien contrastados. Si supiéramos cómo se genera la Biodiversidad, podríamos establecer estrategias de protección consecuentes, sustentadas en datos tangibles (Martín Piera & Lobo, 1992). Entre tanto, la actitud más razonable es: i) ‘cubrirnos las espaldas’ protegiendo más incluso de lo que nos parece necesario y, simultáneamente, ii) promover la realización intensiva de estudios básicos a medio y largo plazo. Entre éstos, merecen especial atención, los siguientes:
1.1. Descubrir, describir e inventariar la diversidad biológica con el contenido que Janzen (1993) y Wheeler (1995) dan a esta tarea y adquirir lo más rápidamente posible el conocimiento filogenético de las especies y grupos de especies, aunque sea un conocimiento in memorian, toda vez que la tasa de destrucción de hábitats y pérdida de especies, no tiene precedentes. Esta tarea, actualmente en franco declive en muchos países, es especialmente acuciante en Insectos.
Es probable que la Taxonomía del futuro se nutrirá de una nueva generación de técnicos en identificación (no necesariamente científicos), expertos en análisis de imagen, programación y otras técnicas informáticas, que podrán escanear cientos de especies por día e identificarlas mediante Sistemas Expertos (e.g.: ‘DELTA’ Dallwitz et al., 1993). Pero esto es sólo tecnología taxonómica no investigación taxonómica. La Taxonomía como disciplina científica, habrá de seguir investigando la variabilidad inter e intrataxonómica de los rasgos/atributos/caracteres a todos los niveles de la jerarquía taxonómica y contrastando las hipótesis evolutivas que en sí mismos establecen los propios taxones. No deberíamos perder de vista esta distinción esencial entre Identificación (Técnica) e Investigación Taxonómica (Ciencia).
1.2. Cartografiar los Puntos Críticos de la Biodiversidad, a escala global, con criterios sistemáticos y ecológicos. Los primeros combinan la información filogenética y biogeográfica y, los segundos permiten establecer la distribución potencial de los organismos analizando las variables ambientales que explican su distribución geográfica, o lo que es igual, el territorio que por sus características ambientales o geográficas debe contener la mayoría de las poblaciones de una especie. Para determinar el área potencial de distribución de una especie se pueden utilizar modelos de regresión entre la presencia/ausencia de una especie en una parcela de territorio y los valores ambientales de dicha parcela, o bien, utilizar los denominados Sistemas de Información Geográfica (SIG)
En el caso particular de los Insectos:
1.3. Investigar los factores (naturales o antrópicos) que determinan las fluctuaciones de las poblaciones de insectos y el modo en que las comunidades responden a las perturbaciones de diversos agentes desestabilizadores.
2.1. El valor de los insectos como animales experimentales nos proporciona una magnífica ventana a la que asomarnos y comprender cómo diferentes poblaciones, especies, ecosistemas y paisajes (antropizados o no), responden a cambios inevitables. Por otro lado, los insectos nos pueden enseñar mucho ya que configuran un mundo complejo que a lo largo de 350 millones de años de evolución, ha ‘inventado’ casi todo. Existe una enorme diversidad de soluciones para resolver el mismo problema. Excepto el medio marino, han ocupado todos los rincones de la Tierra, adaptándose por ejemplo, a soportar temperaturas de 40 - 45°C bajo cero y de 35 a 40 °C sobre cero. El abanico de posibilidades del estudio de los insectos es enorme: protección contra la congelación, envejecimiento, aprendizaje, estrategias reproductivas, etc. (Bellés, 1995). No es casual el hecho de que el 32% de los artículos publicados en una de las más prestigiosas revistas de Ecología (Journal of Animal Ecology), durante los últimos 61 años, hayan versado sobre insectos (Shorrocks, 1993).
3. Los Insectos como muchos otros microorganismos son un componente funcional vital de los ecosistemas casi completamente desconocido. A pesar de ello, siguen siendo objeto de escasa atención en comparación con otros organismos. Muy pocos insectos, incluso los incluidos en las Listas Rojas, están individual y legalmente protegidos. A tenor del enorme impedimento taxonómico en el estudio de los Insectos, se requiere una investigación ingeniosa y aplicable. Sería muy importante que los entomólogos hiciésemos especial hincapié en el hecho de que la valoración del potencial económico de las especies de insectos, está aún por descubrir. Entre tanto, lo más prudente es conservar y preservar tantos biótopos, y paisajes como sea posible. Las Reservas y Parques Nacionales aunque no se designen específicamente para los Insectos, juegan un importante papel. Estas Reservas deberían ser tan grandes como fuera posible, a fin de alojar las ‘extravagancias’ de las poblaciones de insectos y evitar el peligro de extinción per se.
4. La variación de las poblaciones de insectos es tan evidente en los trópicos como en las áreas templadas. Pero la complejidad y variabilidad de tales poblaciones en el espacio y en el tiempo, dificulta extraordinariamente las predicciones en el balance demográfico natalidad/mortalidad de los Insectos, incluso en las especies relativamente bien conocidas.
A pesar de ello, es preciso seguir en el tiempo la evolución demográfica de las poblaciones de insectos a lo largo de su rango geográfico. Habida cuenta de que pequeñas poblaciones aisladas de insectos se extinguen con facilidad Ehrlich & Murphy (1987) han sugerido que sería deseable conservar un mínimo de amplitud metapoblacional.
Los individuos, las poblaciones, las especies y todas las interacciones, quedan protegidas de manera global con la conservación del paisaje. A su vez, los Insectos pueden ser usados como un buen instrumento metodológico en la evaluación de la conservación de los paisajes (Samways, 1993). Los Insectos han demostrado ser buenos indicadores ambientales (Brown, 1991; Holloway & Stork, 1991; Pearson & Cassola, 1992; Halffter & Favila, 1993, Kremen et al., 1993; Favila & Halffter, 1997) aunque las evaluaciones con unas pocas especies proporcionan una ventana muy estrecha (Samways, 1994).
5. La naturaleza dinámica de las poblaciones de insectos, a corto plazo bajo la influencia de los paisajes antropizados y a largo plazo bajo la influencia de cambios geológicos o climáticos, convierte a menudo en un artificio vacío de contenido biológico la adscripción de estos organismos a las categorías de rareza. No es de extrañar, por tanto, que los Libros Rojos y las Listas Rojas, tengan una fuerte carga subjetiva, arbitraria y hasta política, presentando a menudo un fuerte sesgo hacia ciertos grupos estéticamente atractivos como las mariposas o las libélulas. Hoy por hoy, los Libros Rojos de insectos, son una simple guía, nada más.
6. Es difícil imaginar un desarrollo social como el actual sin agredir al medio natural y de éste, el elemento más frágil, es la diversidad biológica. Sin embargo, si en la época postindustrial las sociedades humanas quieren ser dueñas de su propio destino, habrán de regular su actividad y crecimiento, aceptando que el techo de cualquier modelo de desarrollo, es el deterioro del legado más importante de la evolución biológica: La Biodiversidad (Halffter & Ezcurra, 1992). Tal vez hoy no lo acabamos de percibir con claridad, pero todo indica que en la conservación y preservación de la Biodiversidad, a escala global y su uso razonable (sustentable), asegura en última instancia, nuestra propia supervivencia. Esta percepción global de la importancia de la Biodiversidad, trasciende uno de los conceptos más tribales y autistas, pero también más querido, de nuestra sociedad: La Soberanía Nacional. Cada día es más evidente que los problemas medioambientales no pueden ser resueltos localmente. La diversidad biológica, no es una excepción. Los seres vivos y los ecosistemas en los que se estructuran, no entienden de reparto geopolítico. Por ello, es imprescindible derivar recursos económicos hacia los países depositarios de las reservas de Biodiversidad.
7. Estas y otras muchas preocupaciones inspiraron la celebración de la Cumbre de Río de Janeiro. Sin embargo, seamos realistas. Como ha señalado di Castri (1993): ‘... La única esperanza que surge del ‘Espíritu de Río’ descansa casi exclusivamente en los ciudadanos, en la sociedad civil, en las fuerzas productivas y en las auténticas organizaciones no gubernamentales (muchas de las cuales no son sino la coartada de los gobiernos), quienes consolidan un frente de rechazo de lo inaceptable, rechazo a la creencia en documentos deliberadamente ambiguos, rechazo a legitimar lo anacrónico y a las Instituciones estancadas (... algunas al borde de la ineptitud y obsolescencia...) ...’. Más adelante di Castri señala que: ‘... hay demasiados mitos y palabras que han perdido su significado en los documentos de Río; es tal la ausencia de fundamentos científicos, que el actual diálogo sólo conduce al síndrome de la Torre de Babel, con nuevos gurús, nuevos hechiceros y brujos. Los viejos demonios que compartimentan y sectorializan, nunca han estado tan presentes en las Instituciones (especialmente en los aspectos educativos y formativos) y entre los diferentes actores ...’. Di Castri, tampoco se olvida de la comunidad científica a la que acusa de ‘... entrar en el juego a fin de obtener financiación para invertir en los mismos objetivos y las mismas intenciones que antes de Río, es decir, en proyectos que poco tienen que ver con los problemas reales ...’.
Personalmente creo que esta visión demoledora de di Castri, sobre los avances de la Cumbre de Río, se ajusta bastante bien a lo que es el día a día de la cuestión. No hay pues muchos motivos para el optimismo, para el idealismo; debemos esforzarnos en ser realistas. Sin embargo, justo es reconocer que el alegato de di Castri termina con una llamada al coraje y a la lucha contra este estado de cosas.
6. Una última reflexión sobre los Insectos
La gente hallará beneficio en la conservación de los Insectos. No se puede vender bioética a quien pasa hambre, pero se puede ilustrar el valor de los Insectos (Samways, 1994). Como indica este autor, la tarea de los entomólogos es dar a conocer sus hallazgos científicos a todos aquellos que hablan y pugnan por la preservación de la Biodiversidad. Los hallazgos continuarán siendo de carácter taxonómico descriptivo durante bastante tiempo, pero también son hallazgos importantes el último enclave de un raro endemismo, el acusado perfil ecológico de una especie en el bosque lluvioso tropical, el desierto o un sistema de dunas, o la fragilidad de la fauna de una cueva singular ó, incluso, por qué no, algún modelo sobre el impacto del calentamiento global. Toda esta información debe ser difundida a todos aquellos que quieran escuchar, políticos, gestores, ecologistas y público en general y sobre todo, a las futuras generaciones.
Ackery, P. R. & Vane-Wright, R. Y., 1984. Milkweed Butterflies. British Museum (Natural History), London.
Alatalo, R. V., 1981. Problemas in the measurement of evennes in ecology. Oikos, 37: 199-204.
Baltanás, A., 1991. On the use of some methods for the estimation of species richness. Oikos, 65: 484-492.
Bartlein, P. J., Prentice, Y. C. & Webb, T., 1986. Climatic response surfaces from pollen data for some eastern North American taxa. Journal of Biogeography, 13: 35-37.
Baz, A., 1996. Ranking species and sites for butterfly conservation using presence-absence data in Central Spain. Nota lepidopterologica. Suppl., 2: 4-12.
Belles, X., 1995. Tendencias Actuales de la Entomología Ibérica. C. Albaladejo, X. Bellés & F. Martín Piera. En: Avances en Entomología Ibérica, pp. 33-42. Comité Editorial del VI Congreso Ibérico de Entomología (eds.). Museo Nacional de Ciencias Naturales (CSIC) y Universidad Autónoma de Madrid. 502 pp.
Blackmore, S. & Cutler, D., (eds.) 1996. Systematic Agenda 2000. The challenge for Europe. Proceedings of a Workshop organised by the European Sciende Foundation Systematic Biology Network. Linnean Society Occasional Publication - Nº 1. 105 pp.
Blanco, J. C. & González, J. L., 1992. Libro Rojo de los Vertebrados de España. Ministeriro de Agricultura, Pesca y Alimentación. ICONA. Madrid. 714 pp.
Brooks, D. R. & McLennan, D. A., 1993. Phylogeny, Ecology , and Behaviour. A Research program in Comparative Biology. University of Chicago Press. Chicago. 434 pp.
Brooks, D. R. & McLennan, D. A., 1993. Historical ecology: Examining phylogenetic components of community evolution. En: Species Diversity in Ecological Communities. Historical and Geographical perspectives. Ricklefs, R. E. & Schluter, D. (eds.), pp. 267-280. University of Chicado Press. Chicago. 416 pp.
Brown, K., 1991. Conservation of Neotropical environments: Insects as indicators. En: Conservation of Insects and their Environments, pp. 349-404. N. M. Collins and J. A. Thomas (eds.). London, Academic Press.
Buckland, S. T. & D. A. Elston. 1993.- Empirical models for the spatial distribution of wildlife. Journal of Applied Ecology, 30: 478-495.
Caddle, J. E. & Greene, H. W., 1993. Phylogenetic patterns, Biogeography, and the Ecological structure of Neotropical Snake Assemblages. En: Species Diversity in Ecological Communities. Historical and Geographical perspectives. Ricklefs, R. E. & Schluter, D. (eds.), pp. 281-293. University of Chicado Press. Chicago. 416 pp.
Castroviejo, S., 1995. Flora Ibérica. Política Científica, C.I.C.Y.T., 44: 39-43.
Chapin III, F. S., Schulze, E.- D. & Mooney, H. A., 1992. Biodiversity and ecosystems processes. Trends in Ecology and Evolution, 7: 107-108.
Clark, T. E. & Samways, M. J., 1993. Ecological landscaping for conservation of macro-arthropod diversity in a southern hemisphere (Sourh African) urban botanic garden. En: Habitat Creation and Wildlife Conservation in Post-industrical and Urban Habitats. J. Rieley and S. Page eds. Packard. United Kingdom.
Cody, M. L., 1975. Towards a theory of continental species diversity bird distributions over Mediterranean habitat gradients. En: Ecology and Evolution of Communities M. L. Cody and J. M. Diamonds (eds.). Harward University Press, Cambridge, Massachussetts. pp. 214-257.
Colwell, R. & Coddington, J. A., 1994. Estimating terrestrial biodiversity through extrapolation. Philadelphia Transactions Royal Society. London, Ser. B., 345: 101-118.
Cornell, H. V. & Lawton, J. H., 1992. Species interactions, local and regional processes, and limits to the richness of ecological communities: A theoretical perspective. Journal of Animal Ecology, 61: 1-12.
Dallwitz, M. J., Paine, T. A., and Zurcher, E. J. (1993). `User’s Guide to the DELTA System: a General System for Processing Taxonomic Descriptions.’ 4th edition. (CSIRO Division of Entomology: Canberra.).
Darwin, Ch., 1859. On the Origin of Species by Natural Selection: or the Preservation of favoured races in the struggle for life. Ist Edition. London.
di Castri, F., 1993. One year after Rio: I’m guilty! BiologyInternational, 27: 1-2. Editorial.
Doube, B., 1990. A functional classification for analysis structure of dung beetle assemblages. Ecological Entomology, 20 (1): 90-97.
Ehrlich, P. R. & Murphy, D. D., 1987. Conservation lessons from long-term studies of checkersport butterflies. Conservation Biology, 1: 122-131.
Embley, T. M., Hirt, R. P. & Williams, D. M., 1996. Biodiversity at the molecular level: the domains, kingdoms and phyla of life. En: Biodiversity. Measurement and estimation. D. L. Hawksworth (ed.). pp. 21-33. Chapman & Hall. London. 140 pp.
Erwin, T. L., 1982. Tropical forests: their richness in Coleoptera and other arthropod species. Coleopterists Bulletin, 36: 74-75.
Erwin, T. L., 1983 a. Tropical forest canopies, the last biotic frontier. Bulletin of the Entomological Society of America, 29: 14-19.
Erwin, T. L., 1983 b. Beetles and other insects of tropical canopies at Manaus, Brazil, sampled by insecticidial fogging. Pages 59-75. En: Tropical rain forest: ecology and management S. L. Sutton, T. C. Whitmore, and A. C. Chadwick, editors. Blackwell Scientific Publications, Oxford U.K.
Erwin, T. L., 1985. Tambopata reserved zone, Madre de Dios, Peru: History and description of the reserve. Revista Peruana de Entomologia, 27: 1-8.
Erwin, T. L., 1988. The tropical forest canopy: the heart of biotic diversity. Pages 123-129. En: Biodiversity, E. O. Wilson, editor. National Academy Press, Washington, D. C.
Erwin, T. L., 1991. How many species are there?: Revisited. Conservation Biology, 5 (3): 330-333.
Faith, D. P., 1992 a. Conservation evaluation and phylogenetic diversity. Biological Conservation, 61: 1-10.
Faith, D. P., 1992 b. Systematics and conservation: on predicting the future diversity of subsets of taxa. Cladistics, 8: 361-373.
Faith, D. P., 1994. Phylogenetic diversity: a general framework for the prediction of feature diversity. Ed. P. L. Forey, C. J. Humphries & R. Y. Vane-Wright. pp.: 251-268. Systematics Association Special, vol. 50. Oxford University Press Inc., New York. 438 pp.
Faith, D. P., 1996. Phylogenetic pattern and the quantification of organismal biodiversity. En: Biodiversity. Measurement and estimation. D. L. Hawksworth (ed.), pp.: 45-58. Chpamand & Hall, 140 pp.
Farrell, B. D. & Mitter, Ch., 1993. Phylogenetic determinants of Insect/Plant community diversity. En: Species Diversity in Ecological Communities. Historical and Geographical perspectives. Ricklefs, R. E. & Schluter, D. (eds.), pp. 253-266. University of Chicado Press. Chicago. 416 pp.
Favila, M. E. & Halffter, G., 1997. The use of indicator groups for measuring biodiversity as related to community structure and function. Acta Zoologica Mexicana (n.s.), 72: 1-25.
Fisher, R. A., Corbet, A. S., & Williams, C. B., 1943. The relation between the number of species and the number of individuals in a random sample of animal population. Journal of Animal Ecology, 12: 42-58.
Galante, E., 1994. Los invertebrados, los grandes desconocidos en los programas de protección medioambiental. En: Environmental Management and Artrhopod Conservation. pp. 75-88. Asociación española de Entomología ed. 179 pp.
García-Valdecasas, A., Bello, E. & Becerra, J. M., (eds.) 1994. DIRTAX: Directorio de Taxonónomos Españoles. Graellsia Número extraordinario. Museo Nacional de Ciencias Naturales. CSIC.. Madrid. 223 pp.
Gaston, K. J., 1991.- The magnitude of global insect species richness. Conservation Biology, 5 (3): 283-330.
Gaston, K. J. & Lawton, J. H., 1990. Effects of scale and habitat on the relationship between regional distribution and local abundance. Oikos, 58: 329-335.
Gauthier, J., Kluge, A. G. & Rowe, T., 1988. Amniote phylogeny and the importance of fossils. Cladistics, 4: 105-129.
Gibbons, D. W., Reid, J. B. & Chapman, R. A., 1993. The New Atlas of Breeding Birds in Britain and Ireland: 1988-91. Poyser, London.
Grombridge, B. (ed.) 1992. Global Biodiversity. Status of the Earth’s Living Resources. Chapman & Hall, London.
Groom, M. J. & Schumaker, N., 1993. Evaluating landscape change: patterns of worldwide deforestation and local fragmentation. En: Biotic interactions and global change. Kareiva, P. M., Kingsolver, J. G. & Huey, R. N., (eds.) pp. 24-44. Sinauer, Sunderland. Ma.
Halffter, G. & Ezcurra, E., 1991. ¿Qué es la Biodiversidad?. En: La Diversidad Biológica de Iberoamérica, pp.3-24. Acta Zoologica Mexicana (n.s.). Volúmen especial de 1992. G. Halffter compilador. CYTED-D, Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo. Mexico D. F. 389 pp.
Halffter, G. & Favila, M. E., 1993. The Scarabaeinae (Insecta: Coleoptera), an animal group for analyzing, inventoring and monitoring biodiversity in tropical rainforest and modified landscapes. Biology International, 27: 15-21.
Hammond, P., 1995. The Current Magnitud of Biodiversity En: Magnitud and Distribution of Biodiversity, Hawksworth, D. L. & Kalin-Arroyo, M. T. (Co-ordinat.). pp. 113-138. Chap. 3 of the Global Biodiversity Assessment. Heywood, V. H. & Watson, R. T. (eds.), United Nations Environment Program. Cambridge University Press. 1125.
Harper, J. L. & Hawksworth, D. L., 1996. Preface of Biodiversity. Measurement and Estimation. En: Biodiversity. Measurement and estimation. D. L. Hawksworth (ed.). pp. 5-12. Chapman & Hall. London. 140 pp.
Haydon, D., Radtkey, R. R. & Pianka, E. R., 1993. Experimental Biogeography: Interactions between Stochastic, Historical, and Ecological Processes in a model Archipielago. En: Species Diversity in Ecological Communities. Historical and Geographical perspectives. Ricklefs, R. E. & Schluter, D. (eds.), pp. 117-130. University of Chicado Press. Chicago. 416 pp.
Heltshe, J. F. & Forrester, N. E., 1983. Estimating species richness using the Jacnnife procedure. Biometrics, 39: 1-11.
Hill, M. O., 1973. Diversity and evennes: a unyfying notation and its consequences. Ecology, 54: 427-431.
Holloway, J. D. & Stork, N. E., 1991. The dimensions of biodiversity: The use of invertebrates as indicators of human impact. En: The Biodiversity of Microorganisms and Invertebrates: Its Role in _Suitable Agriculture, pp. 37-62. D. L. Hawksworth (ed.). CAB International, Wallingford, U.K.
Humphries, C. J., Williams, P. H. & Vane-Wright, R. I., 1995. Measuring Biodiversity value for conservation. Annual Review Ecology and Systematics, 26: 93-111.
Huntley, B. Berry, P. M., Cramer, W & McDonald, A. P., 1995. Modelling present and potential future ranges of some European higher plants using climate response surfaces. Journal of Biogeography, 22: 967-1001.
Hurlbert, S: H., 1978. The non-concept of species diversity: a critique and alternative parameters. Ecology, 59: 67-77.
IUCN, 1990. The 1990 IUCN Red List of Threatened Animals, IUCN Gland. Swuitherland, and Cambridge, United Kingdom.
Janzen D. H.,1993. What does tropical society want from the Taxonomists? En: Hymnoptera and Biodiversity. pp.: 295-307. J. Lasalle & Gauld, I. D., edit. C.A.B. International, 348 pp.
Jones, P. G., Sthephen. E., Joe Thome, B, Galwey, N. W., 1997.- The use of geographical information systems in biodiversity exploration and conservation. Biodiversity Letters, 6: 947-958.
Jiménez-Peydró, R. Marcos-García, M. A. (eds.) 1994. Environmental Management and Artrhopod Conservation. Asociación española de Entomología ed. 179 pp.
Kikkawa, J. & Williams, E. E., 1971. Altitudinal distributio of land birds in New Guinea. Search, 2: 64-69.
Krebs, C. J., 1985. Ecology: The experimental analysis of Distribution and Abundance. Blackwell, Oxford.
Kremen, C., Colwell, R. K., Erwin, T. L., Murphy, D. D., Noss, R. F., & Saujayan, M. A., 1993. Terrestrial Arthropods assamblages; Their use in conservation planning. Conservation Biology, 7 (4): 796-808.
Lobo, J. M., 1993. La Base de la Ecología. Edit. Penthalon. Madrid. 155 pp.
Lobo, J. M., 1998. Influencias geográficas, históricas y filogenéticas sobre la diversidad de las comunidades locales: una revisión y algunos ejemplos utilizando Scarabaeoidea coprófagos (Coleoptera: Laparosticti). Boletín de la Asociación española de Entomologia, 21 (3-4): 15-31.
Lobo, J. M. & Martín Piera, F., 1993. Las causas de la Biodiversidad. Arbor, 145: 91-113.
Ludwig, J. A. & Reynolds, J. F., 1988. Statistical Ecology. A primer on methods and computing. John Wiley & Sons. New York. 337 pp.
MacArthur, R. H., 1957. On the relative abundance of bird species. Proceedings of the Natural Academy of Sciences, USA., 43: 293-295.
MacArthur, R. H., & Wilson, E. O., 1963. An equilibrium theory of insular zoogeography. Evolution, 17: 373-387.
MacArthur, R. H., & Wilson, E. O., 1967. The Theory of Island Biogeography. The Princeton Univeristy Press. Princeton.
McNaughton, S. J., 1995. Conservation goals and the configuration of biodiversity. En: Systematics and Conservation Evaluation. Ed. P. L. Forey, C. J. Humphries & R. Y. Vane-Wright. pp.: 41-62. Systematics Association Special, vol. 50. Oxford University Press Inc., New York. 438 pp.
McNeely, J. A., Miller, K. R., Reid, W. V., Mittermeier, R. A. & Werner, T. B., 1990. Conserving the world’s biological diveristy. IUCN, WRI, CI, WWF and World Bank, Washington, DC.
Magurran, A. E., 1988. Ecological Diversity and Its Measurement. Princeton University Press, New Jersey. 179 pp.
Margalef, R., 1958. Information theory in ecology. General Systematics, 3: 36-71.
Martín Piera, & Fernández Torres, A., 1996. Coleópteros de la Sierra de Chiribiquete (Caquetá, Colombia). ELYTRON, 10: 23-50.
Martín Piera, F. & Lobo, J. M., 1992. La conservación de la biodiversidad: ciencia y ficción. Eos, 68 (1): 91-92.
May, R., M., 1986. How many species are there?. Nature, 324: 514-515.
May, R., M., 1988. How many species are there on the earth?. Science, 241: 1441-1449.
May, R., M., 1989. How many species are there? En: The Fragile Environments. Friday, L. & Laskey, R., (eds.). Cambridge Univeristy Press, Cambridge, pp. 61-81.
May, R. M., 1990 a. Taxonomy as destiny. Nature, 347: 129-130.
May, R. M., 1990 b. How many species). Phylosophical transactions of the Royal Society, B330: 293-304.
May, R. M., 1992. Past efforts and future prospects towards understanding how many species there are. En: Biodiversity and Global Change. O. T. So.lbrig et al. (eds.) pp. 71-81. IUBS Monograph No. 8.
May, R. M., 1996. Conceptual aspects of the quantification of the extent of biological diversity. En: Biodiversity. Measurement and estimation. D. L. Hawksworth (ed.). pp. 13-20. Chapman & Hall. London. 140 pp.
May, R., M., Lawton, J. H. & Stork, N. E., 1995. Assesing extinction rates. En: Extinction Rates. Lawton, J. H. & May, R. M. (eds.) pp. 1-24. Oxford University Press. Oxford. 233 pp.
Mickevich, M. F. & Platnick, N. I., 1989. On the information content of classifications. Cladistics, 5: 33-47.
Myers, A. A. & Giller, P. S., (eds.) 1988. Analytical Biogeography. An integrated approach to the study of animal and plant distribution. Chapam & Hall. London. 578 pp.
Nieto-Nafría, J. M., 1994. Comentarios al ‘Manifiesto de Calpe’. En: Environmental Management and Artrhopod Conservation pp. 163-168. Asociación española de Entomología ed. 179 pp.
Norse,E. A., Rosenbaum, K. L., Wilcove, D. S., Wilcox, B. A., Romme, W. H., Johnston, D. W. & Stout, M. L., 1986. Conserving biological diversity in our national forests. Washington, D. C.: The Wilderness Society.
Pearson, D. L., & Cassola, F., 1992. World-wide species richness patterns of tiger beetles (Coleoptera: Cicindelidae): indicator taxon for biodiversity and conservation studies. Conservation Biology, 6: 376-391.
Pearson, D. L. & Juliano, S. A., 1993. Evidence for the influence of Historical processes in Co-occurrence and diversity of tiger beetles. En: Species Diversity in Ecological Communities. Historical and Geographical perspectives. Ricklefs, R. E. & Schluter, D. (eds.), pp. 194-202. University of Chicado Press. Chicago. 416 pp.
Pielou, E. C., 1975. Ecological Diversity. John Wiley, New York.
Pielou, E. C., 1977. Mathematical Ecology. John Wiley, New York.
Prance, G. T., 1996. A comparison of the efficacy of higher taxa and species numbers in the assessment of biodiversity in the tropics. En: Biodiversity. Measurement and estimation. pp. 89-100. D. L. Hawksworth (ed.). Chapman & Hall, 140 pp.
Preston, F. W., 1948. The commonness, and rarity, of species. Ecology, 29: 254-283.
Rabinowitz, D., Cairns, S. & Dillon, Th., 1986. Seven forms of rarity and their frequency in the flora of British Isles. En: Conservation Biology. The Science of Scarcity and Diversity. Ed. Michael E. Soulé. pp. 182-204. Sinauers Associates, Inc. Massachusetts 584 pp.
Ramos, M. A., 1995. Fauna Ibérica. Política Científica, C.I.C.Y.T., 44: 35-38.
Raup, D. M., 1988. Diversity crises in the geological past. En: Biodiversity, E. O. Wilson editor, pp. 51-57. National Academy Press, Washington, D. C. 521 pp.
Raven, P. H., 1988. Our diminishing tropical forests. En: Biodiversity, E. O. Wilson editor, p. 119-122. National Academy Press, Washington, D. C. 521 pp.
Reid, W. V., 1992. How many species will there be?. En: Tropical deforestation and especies extinction. Whitmore, T. C. & Sayer, J. A., pp. 55-73. Chapman & Hall, London.
Ricklefs, R. E.., 1995. The distribution of biodiversity En: Magnitud and Distribution of Biodiversity, Hawksworth, D. L. & Kalin-Arroyo, M. T. (Co-ordinat.). pp. 139-173. Chap. 3 of the Global Biodiversity Assessment. Heywood, V. H. & Watson, R. T. (eds.), United Nations Environment Program. Cambridge University Press. 1125.
Ricklefs, R. E. & Schluter, D., 1993. Species Diversity: Regional and Historical influences. En: Species Diversity in Ecological Communities. Historical and Geographical perspectives. Ricklefs, R. E. & Schluter, D. (eds.), pp. 350-360. University of Chicado Press. Chicago. 416 pp.
Rosas, G., Ramos, M. A. & García-Valdecasas, A., 1992.- Invertebrados españoles protegidos por Convenios Internacionales. ICONA. Ed. Madrid. 250 pp.
Rex, M. A., 1981. Community structure in the deep-sea benthos. Annual Review Ecology and Systematics, 12: 331-354.
Salt, G., 1979. A comment on the use of the term emergent properties. American Naturalist,113: 145-148.
Samways, M. J., 1990. Landforms and winter habitat refugia in the conservation of montane grassoppers in southern Africa. Conservation Biology, 4: 375-382.
Samways, M. J., 1983. Commnity structure of ants (Hymnoptera: Formicidae) in a series of habitats associated with citrus. Journal of Applied Ecology, 20: 833-847.
Samways, M. J., 1993. A spatial and process sub-regional framework for insect and biodiversity conservation research and management. En: Perspectives on Insect Conservation. Gaston, K. J., New, T. R. & Samways, M. J. (Eds.)., pp. 1-28. Intercept ltd., Andover, U.K., 250 pp.
Samways, M. J., 1994. Insect Conservation Biology. Chapman & Hall. London, 358 pp.
Scott, J. M., F. Davis, B. Csuti, R. Noss, B. Butterfield, C. Groves, H. Anderson, S. Caicco, F. D’Erchia, T. C. Edwards, J. Ulliman & R. G. Wright. 1993. Gap Analysis: A geographic approach to protection of biological diversity. Wildlife Monographs, 123: 1-41.
Shorrocks, B., 1993. Trends in Journal of Animal Ecology: 1932-1992. Journal of Animal Ecology, 62: 599-605.
Skov, F. & Borchsenius, F., 1997. Predicting plant species distributio patterns using simple climatic parameters: a case study of Ecuadorian palms. Ecography, 20: 347-355.
Smith, P. A., 1994. Autocorrelation in logistic regression modelling of species’ distributions. Global Ecology and Biogeography Letters, 4: 47-61.
Solbrig, O. T. (ed.), 1991 a. From genes to ecosystems: a research agenda for biodiversity. Cambridge, Massachusseetts,: International Union of Biological Sciences.
Solbrig, O. T., 1991 b. Biodiversity. A review of the scientific issues and a proposal for a collaborative program of research. MAB Digest 9, UNESCO.
Suttons, S. l. & Collins, N. M., 1991. Insect and tropical forest conservation. En: The Conservation of Insects and their habitats. Eds. N. M. Collins and J. A. Thomas. 15th Symposium of the Royal Entomological Society of London. AcademicPress, London. pp. 405-424.
Taylor, L. R., 1978. Bates, Williams, Hutchinson - a variety of diversities. En: Diversity of Insect Faunas: 9th Symposium of the Royal Entomological Society. Eds. L. A. Mound and N. Warloff, Blackwell, Osford, pp. 1-18.
Terborgh, J., 1977. Bird species diversity on Andean elevational gradient. Ecology, 58: 1007-1019.
Valkenbourgh, B. van & Janis, Ch. M., 1993. Historical diversity patterns in North American large herbivores and carnivores. En: Species Diversity in Ecological Communities. Historical and Geographical perspectives. Ricklefs, R. E. & Schluter, D. (eds.), pp. 230-340. University of Chicado Press. Chicago. 416 pp.
Vane-Wright, R. I., Humphries, C. J., Williams, P. H., 1991. What to protect?-Systematics and the Agony of a Choice. Biological Conservation, 55: 235-254.
Wheeler, Q. D., 1990. Insect diversity and cladistic constraints. Annals of the Entomological Society of America,83: 1031-1047.
Wheeler, Q. D., 1995. Systematic, the scientific basis for inventories of biodiversity. Biodiversity and Conservation, 4: 476-489.
Whittaker, R. H., 1960. Vegation of the Siskiyou Mountains, Oregon and California. Ecological Monographs, 30: 279-338.
Whittaker, R. H., 1970. Communities and Ecosystems. Macmillan, New York.
Whittaker, R. H., 1975. Communities and Ecosystems, 2ª edición, Macmillan, New York.
Whittaker, R. H. & Niering, W. A., 1975. Vegetation of Santa Catalina Mountains, Arizona. V. Biomass, production and diversity along the elevational gradient. Ecology, 56: 771-790.
Williams, C. B., 1964. Patterns in the Balance of Nature and related problems in quantitative ecology. Academic Press London.
Williams, P. H., 1991. The bumble bees of the Kashmir Himalaya (Hymenoptera: Apidae, Bombini). Bulletin British Museum (Natural History), Entomology, 60: 1-204.
Williams, P. H., 1993. Measuring more of biodiversity for choosing conservation areas, using taxonomic relatedness. International Symposium on Biodiversity and Conservation (KEI) Korean Entomological Institute, Seoul, pp. 194-227 in Moon, T.-Y. (ed.)
Williams, P. H., 1995. Phylogenetic relationships among the bumble bees (Bombus Latr.): a re-appraisal of morphological evidence. Systematic Entomology, 19: 327-344.
Williams, P. H. & Gaston, K. J., 1994. Measuring more of biodiversity: can higher-taxon richness predict wholesale species richness? Biological Conservation, 67: 211-217.
Williams, P. H & Humphries, C. J., 1994. Biodiversity, taxonomic relatedness, and endemism in conservation. En: Systematics and Conservation Evaluation. Ed. P. L. Forey, C. J. Humphries & R. Y. Vane-Wright, pp. 269-287. The Systematics Association Special Vol. 50. Oxford Science Publications. 438 pp.
Williams, P. H. & Humphries, C. J., 1996. Comparing character diversity among biotas. En: Biodiversity. A Biology of Numbers and Difference, pp. 54-76. Ed. Kevin J. Gaston. Blackwell Science Ltd. Osford, 386 pp.
Williams, P. H., Vane-Wright, R. I. & Humphries, C. J., 1993. Measurign biodiversity for choosing convervation areas. En Hymenoptera and biodiversity. Ed. J. LaSalle & I. D. Gauld, pp. 309-328. CAB International, Wallingford, United Kingdom.
Williams, P. H., Humphries, C. J. & Gaston, K. J., 1994 a. Centres of seed-plants diversity: the family way. Proceedings of the Royal Entomological Society London. B 256: 67-70.
Williams, P. H., Gaston, K. J. & Humphries, C. J., 1994 b. Do conservationists and molecular biologists value differences between organisms in the same way?. Biodiversity Letters, 2: 67-78.
Williams, P. H., Gaston, K. J. & Humphries, C. J., 1997 a. Mapping biodiversity value worldwide: combining higher-taxon richness from different groups. Proceedings of the Royal Entomological Society, Biological Sciencies, 264: 141-148.
Williams, P. H., Vane-Wright, D., Humphries, C., Kitching, I., Lees, D., Araujo, M. & Gaston, K., 1997 b. Biodiversity. Measuring the variety of Nature & Selecting priority Areas for Conservation. Copyright Ó ‘The Natural History Museum Web Site’: http: //www.nhm.ac.uk/science/projects/worldmap
Williams, P. H., Gibbons, D., Margules, C., Rebelo, A., Humphries, C. J. & Pressey, R. A. A comparison of richness hotspots, rarity hotspots, and complementary areas for conserving diveristy using British birds. Conservation Biology; en prensa.
Williams, P. H, Prance, G. T., Humphries, C. J. & Edwards, K. S. Promise and problems in applying quantitative complementary areas for representing the diversity of some Neotropical plants (families Dichapetalaceae, Lecythidaceae, Caryocaraceae, Chrysoblanaceae and Proteaceae). Biological Journal of the Linnean Society; en prensa.
Wilson, E. O., 1988. The current state of biological diversity. En: Biodiversity, E. O. Wilson editor, pp. 3-18. National Academy Press, Washington, D. C. 521 pp.
Wilson, E. O., 1991. Ants. Wings, 16: 3-13.
1[ Teorema del Límite Central: Todas las variables estadísticas aditivas , tienen una distribución Normal o Gausiana. En consecuencia, el logaritmo del número de individuos tiene una variación Normal o Gausiana a lo largo del tiempo.] [Volver]